- Detalles
- Escrito por Jesús Benayas
- Categoría: Física y Química de 3º E.S.O.
- Visto: 4411
1. Introducción
Las sustancias químicas están formadas por agrupaciones de átomos; incluso las últimas partículas de las sustancias simples como el hidrógeno (H2) o el oxígeno (O2) están formadas por la unión de varios átomos, solo los gases nobles están en la naturaleza como átomos aislados. El enlace químico es el responsable de la unión estable entre dos o más átomos.
Todos los sistemas físicos tienden a alcanzar el estado de mínima energía, los átomos se unen con la misma finalidad, formar sustancias con menor energía que la que tendrían los átomos por separado. En este proceso intervienen fuerzas de origen electrostático, tanto de atracción como de repulsión, que ocasionan que los electrones de las capas más externas de los átomos se redistribuyan en sus nuevas localizaciones.
En esta animación se aprecia como funciona el pozo de potencial.
Aquí vemos la curva de estabilidad energética que muestra la variación de energía que experimenta un sistema formado por dos átomos en función de la distancia que los separa. En ella se observa que para la distancia internuclear (Re), denominada distancia de enlace o radio de enlace el sistema es más estable, pues predominan las fuerzas atractivas sobre las repulsivas.
De la configuración electrónica de la capa más externa, depende el tipo de enlace que forman los átomos. Los electrones que se sitúan en esa capa se conocen como electrones de valencia. Lewis toma como modelo de estabilidad a los gases nobles que presentan una distribución electrónica con los orbitales s y p del último nivel llenos (ns2 np6).
Los átomos tienden a captar, a ceder o a compartir electrones hasta quedar rodeados de ocho electrones de valencia.
Para destacar los electrones de valencia, usa diagramas de puntos de Lewis, en los que se dibujan rodeando el símbolo del elemento tantos puntos como electrones posea en la última capa. Aquí vemos los diagramas de puntos de los elementos del segundo periodo:
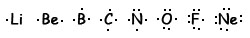
En cualquier caso la formación espontánea de un enlace manifiesta la tendencia de cada átomo a alcanzar la configuración electrónica más estable posible, la de menor energía.
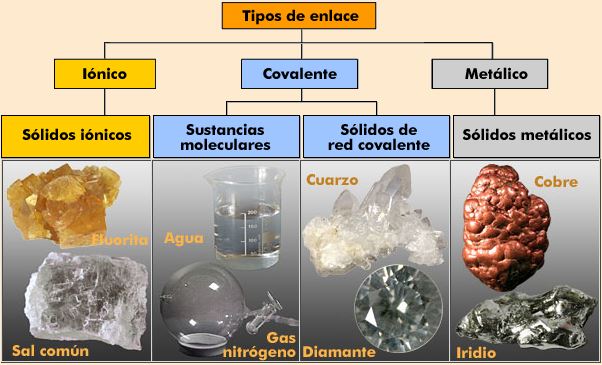
2. Enlace iónico
2.1. Estructura del enlace iónico
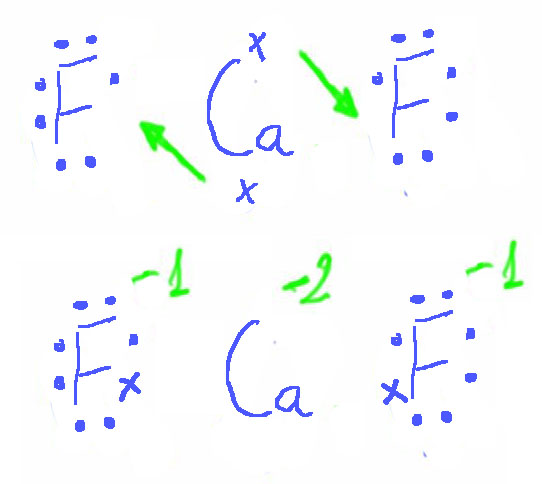
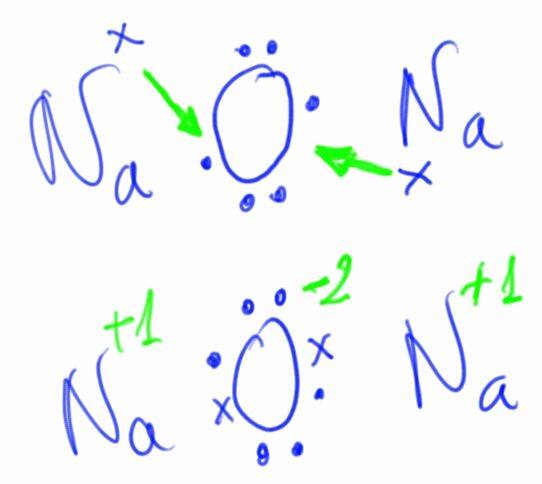
Cuando se unen un elemento muy electropositivo (metal) con otro muy electronegativo (no metal) se forma entre ellos un enlace iónico. Este consiste en una transferencia de uno o varios electrones del átomo del elemento metálico al no metálico, formándose dos iones que se unen por atracción electrostática.
Podemos representar la reacción mediante un diagrama de puntos:
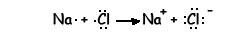
El sodio y el cloro han conseguido alcanzar la estructura electrónica de gas noble.
|
Na 1s2 2s2 2p6 3s1 |
Cl 1s2 2s2 2p6 3s2 3p5 |
|
Na+ 1s2 2s2 2p6 |
Cl- 1s2 2s2 2p6 3s2 3p6 |

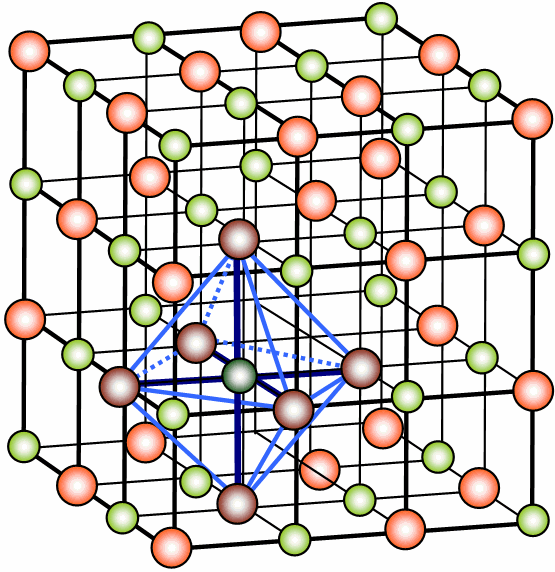
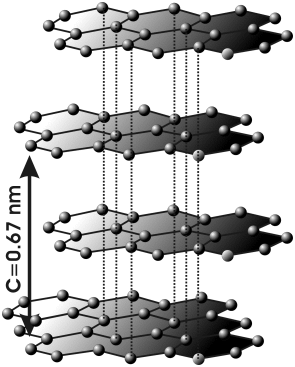
2.2. Redes cristalinas
El cristal del que hablamos antes está formado por iones de signo opuesto unidos entre si por fuerzas electrostáticas que hacen que cada uno se rodee de iones de carga opuesta. En condiciones ordinarias los compuestos iónicos son sólidos, los iones positivos (Na+) y negativos (Cl-) están prácticamente en contacto y se hallan dispuestos en posiciones fijas formando una estructura ordenada que se extiende indefinidamente en el espacio, formando retículos cristalinos o redes espaciales.
2.3. Propiedades de los compuestos iónicos
Los cristales iónicos tienen están formados por aniones y cationes que se unen debido a las fuerzas de electrostáticas, estos iones suelen ser de distinto tamaño y pueden tener distintas cargas, lo que da como resultado distintas estructuras reticulares.
Las propiedades de los compuestos iónicos se explican en función de su estructura y de las intensas fuerzas eléctricas existentes entre los iones positivos y los negativos.
A temperatura ambiente, los compuestos iónicos son sólidos. Sus temperaturas de fusión y ebullición son altas o muy altas, debido a la gran intensidad de las fuerzas electrostáticas entre iones de carga opuesta.
Los cristales iónicos suelen ser duros (cuesta rayarlos) debido a la gran intensidad de las fuerzas electrostáticas de atracción.
Los sólidos iónicos son frágiles. Si se aplica una fuerza sobre el material, las capas de los iones se deslizan y los de igual signo quedan enfrentados y se repelen, de modo que el cristal se rompe (no puede deformarse).
Muchos compuestos iónicos son solubles en disolventes polares como el agua. Las moléculas polares presentan separación de cargas, de forma que una parte de ellas es positiva y otra negativa. De este modo, en presencia de una sal, las moléculas polares del agua se disponen alrededor de los iones de la sal (proceso de solvatación) y ayudan a su dispersión.
Conductividad eléctrica
Los compuestos iónicos no conducen la electricidad en estado sólido debido a que los iones no pueden desplazarse, al ocupar posiciones fijas en la red. Por el contrario, sí conducen la electricidad en estado líquido o en disolución, pues en esos casos los iones tienen libertad para desplazarse.
3. Enlace covalente.
El enlace covalente entre dos átomos se origina cuando estos comparten electrones, completando su capa de valencia a 2 o a 8 e– (regla del octeto). Cada par de electrones compartido se considera un enlace y se representa con un guión largo.
Se produce entre átomos electronegativos (no metales). La mayoría de las sustancias que nos rodean (plástico, madera, agua, oxígeno, glucosa) tienen sus átomos unidos por este tipo de enlace.
Un enlace covalente consiste en la compartición de uno o más pares de electrones entre dos átomos, cumpliendo la regla del octeto. Estos electrones compartidos se sitúan entre los átomos, ejerciendo su atracción sobre ellos y manteniéndolos así unidos.
3.1. Estructuras de Lewis.
Para destacar los electrones de valencia, compartidos o no, se usan diagramas o estructuras de Lewis, en ellas cada átomo se indica con su símbolo rodeado de unos puntos que representan los electrones de valencia. Estos pueden aparecer también como cruces (para diferenciarlos de los del otro átomo) o como rayas (una raya representa un par de electrones)
Aquí tenéis las estructuras de Lewis de algunas sustancias:

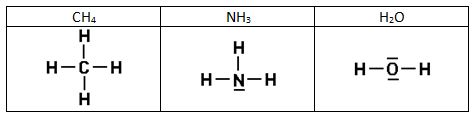
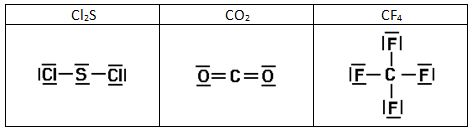
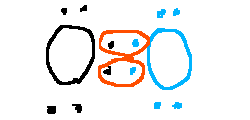
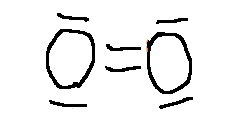
3.2. Propiedades de las sustancias covalentes
Entre las sustancias con enlaces covalentes podemos distinguir dos tipos, con estructura y propiedades muy diferentes.
a) Sustancias moleculares
Pertenecen a este grupo las sustancias constituidas por moléculas cuyos átomos están unidos por enlace covalente. Entre ellas hay sustancias que a temperatura ambiente suelen estar en forma gaseosa, sobre todo aquellas en las que el enlace es apolar (He, H2, O2, N2, CH4, NH3, HCl, SO2, NO2, etc...), en forma líquida (H2O, Br2, CH3-CH2OH, ClCH2-CH3, etc…) e incluso en estado sólido (I2, naftaleno, glucosa, etc…).
Propiedades físicas de las sustancias moleculares:
- Las temperaturas de fusión y de ebullición son bajas. En condiciones ordinarias, la mayoría de estas sustancias se encuentran en estado gaseoso como hemos indicado antes, otras son líquidas y las menos se encuentran en estado sólido. Estas últimas subliman con facilidad ya que la presión de vapor cerca del punto de fusión es muy elevada y en general funden por debajo de los 300 ºC. Esto se deriva de la debilidad de las fuerzas intermoleculares, una pequeña agitación térmica es suficiente para desordenar y separar las moléculas. Así se explican las bajas temperaturas de fusión y de ebullición.
- Suelen ser blandos, compresibles y fácilmente deformables. Esto se debe a la debilidad de las fuerzas intermoleculares.
- Las sustancias apolares son insolubles en disolventes polares como el agua, pero se disuelven bien en disolventes apolares como el tetracloruro de carbono. Las sustancias polares son más solubles en agua. Esto se debe a que la disolución sólo es posible si las fuerzas de atracción que ejercen las moléculas del soluto entre sí, y las moléculas del disolvente entre sí, pueden intercambiarse, lo que ocurre si son de la misma naturaleza y parecida intensidad.
- Las sustancias que forman cristales moleculares son, en general, buenos aislantes eléctricos. Esto se debe a que las moléculas no poseen carga eléctrica neta y, por tanto, no pueden transportar la carga como la transportan compuestos iónicos fundidos. Además, los electrones que forman los enlaces covalentes están fijos en sus orbitales moleculares lo que impide su desplazamiento, ello impide una conductividad similar a la de los metales.
b) Sustancias con red covalente (o reticulares)
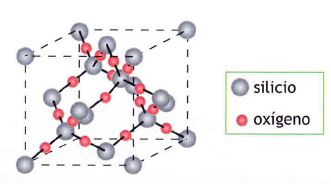
Por qué el CO2 es gaseoso en condiciones normales y el SiO2 es un sólido de gran dureza si son dióxidos de elementos contiguos de la misma familia. La razón es la diferente estructura de uno y otro. El dióxido de carbono está formado por moléculas discretas de CO2 y SiO2 forma una red cristalina covalente.
Cada átomo de silicio se dispone de forma tetraédrica rodeado de cuatro O. No hay moléculas individuales, un cristal de sílice es como una gigantesca molécula, ya que todos los átomos que lo constituyen están unidos entre sí por enlaces covalentes. El CO2 no puede tener estructura análoga pues el pequeño volumen del átomo de C le impide rodearse de cuatro átomos de 0, que estarían demasiado próximos entre sí y sufrirían la repulsión de sus nubes electrónicas.
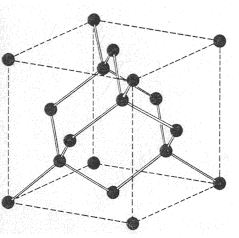
El carbono, en la variedad alotrópica diamante, muestra una estructura cristalina covalente, tetraédrica (hibridación sp3), muy parecida a la del Si02. Pero, en la variedad de grafito, el mismo carbono, muestra una estructura covalente en capas de hexágonos (hibridación sp2).
Suelen presentar estructuras con red covalente los elementos situados en la diagonal: B, C, Si, Ge, As, Sb, etc., de la tabla periódica.
Propiedades de las sustancias reticulares.
Tienen temperaturas de fusión muy elevadas (hasta 4000ºC en el diamante) ya que la fusión de un cristal atómico requiere la ruptura de un gran número de enlaces covalentes, muy fuertes.
Son muy duros e incompresibles, ya que los enlaces covalentes tienen direcciones fijas en función de la hibridación que se forme y cualquier deformación en sólidos como Si02, Si o C (diamante) implica la ruptura de múltiples enlaces covalentes, lo que requiere una gran cantidad de energía.
Son insolubles ya que su disolución requiere también la ruptura de gran cantidad de enlaces covalentes.
En general no conducen la electricidad, aunque hay algunas excepciones (el grafito puede conducir en las direcciones paralelas a los planos hexagonales)
4. Enlace metálico
4.1. Propiedades de los metales.
Las siguientes propiedades son comunes a todos los metales:
• Buenos conductores de la electricidad, tanto en estado sólido como fundidos. Un aumento de temperatura disminuye su conductividad eléctrica.
• Alta conductividad térmica.
• Densidades generalmente elevadas.
• Son dúctiles (se pueden alargar en hilos) y maleables (capaces de ser reducidos a láminas).
• Temperaturas de fusión y de ebullición relativamente elevadas. Todos los metales, salvo el mercurio, tienen temperaturas de fusión superiores a los 25ºC.
• Poseen brillo metálico.
• Son insolubles en agua y en disolventes orgánicos. Algunos metales reaccionan con el agua.
Se debe señalar que entre los propios metales existen grandes diferencias en cuanto a los valores de una determinada propiedad. Existen valores muy distintos cuando se comparan metales representativos con metales de transición.
4.2. Modelo de enlace metálico
Existen diversas teorías que tratan de dar explicación a la forma en que están unidos los átomos en los metales (y sus aleaciones) ya las propiedades más características de los mismos. En este curso solo veremos la siguiente:
Modelo del gas electrónico o del mar de electrones
Este modelo se basa en la suposición de que los metales están formados por la aglomeración de iones positivos bañados por un mar de electrones o sumergidos en un gas electrónico.
En esta situación, los electrones no pertenecen a los átomos individuales, sino que todos ellos son comunes al conjunto de los átomos que forman la red; es decir, están deslocalizados.
Esto explicaría su relativa facilidad para desplazarse por la estructura metálica, lo que produce las elevadas conductividades halladas y los efectos de emisión electrónica.
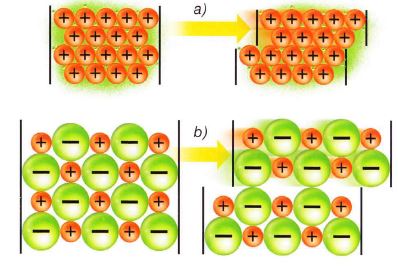
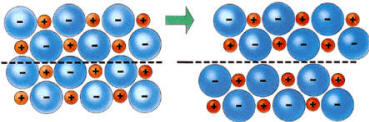
Esta teoría también justifica las especiales características de moldeo que tienen los metales (a) pues, al aplicar una fuerza, se produce un desplazamiento de las capas iónicas en las estructuras que no produce una variación importante en las mismas, por lo que no se rompen. En cambio, en el caso de cristales iónicos (b) se observa una gran inestabilidad de tipo electrostático por estos desplazamientos.
- Detalles
- Escrito por Jesús Benayas
- Categoría: Física y Química de 3º E.S.O.
- Visto: 2345
Pendientes de Física y Química de 3º de E.S.O.
PARA RECUPERAR
Las actividades de recuperación para los alumnos de 4º de E.S.O. con la materia de Física y Química pendiente de 3º de E.S.O. se concretarán en los siguientes puntos:
- No hay asignación horaria para atención a alumnos con pendientes. Dado que el jefe de departamento no da clase a todos los alumnos en esta situación, la información relativa al proceso de recuperación se hará mediante el uso del tablón de anuncios, comunicaciones al tutor y a través del tutor de pendientes.
- Los alumnos que cursen la materia de Física y Química de 4º de E.S.O. y que tengan pendiente la de 3º de E.S.O., aprobarán la materia pendiente si aprueban la homónima de 4º de E.S.O.
- No obstante, es recomendable que sigan paralelamente el procedimiento para el resto del alumnado, ya que en caso de suspender la de 4º, tendrían dos materias evaluadas negativamente de cara a la obtención del título de Graduado en E.S.O., mientras que siguiendo el otro procedimiento podrían aprobar la de 3º independientemente del resultado obtenido en la de 4º.
Los alumnos que no cursen la materia de Física y Química de 4º de E.S.O. y que tengan pendiente la de 3º de E.S.O., podrán realizar tres pruebas escritas a lo largo del curso con el fin de superar la materia pendiente. Las pruebas versarán sobre los contenidos de la programación de Física y Química de 3º de E.S.O. Los alumnos podrán prepararse con el cuadernillo de recuperación de Física y Química de 3º de E.S.O. que el departamento ha preparado al efecto. El cuadernillo se puede descargar más abajo.
Este año se adaptan en función de lo que se explicó de manera presencial durante el curso 2019-20 (1ª y 2ª evaluación).
- La primera prueba se realizará el día 16 de diciembre de 2020, de 11:45 a 12:40, en el laboratorio de Física. La prueba versará sobre las unidades didácticas 1 (El método científico) y 2 (La materia y sus estados), que se corresponden con los ejercicios 1 al 84 del cuadernillo.
- La segunda prueba se realizará el día 10 de febrero de 2021, de 11:45 a 12:40, en el laboratorio de Física. La prueba versará sobre el resto de las unidades didácticas, que se corresponden con los ejercicios 85 al 182 del cuadernillo.
- Se realizará la media de ambas notas siempre que ninguna de ellas esté por debajo de 3 puntos. Si esta nota está por encima de 5 la asignatura se considera aprobada.
- La tercera prueba se realizará el día 12 de mayo de 2021, de 11:45 a 12:40, en el laboratorio de Física. La prueba versará sobre todas las unidades didácticas de la programación de Física y Química de 3º de E.S.O., que se corresponden con los ejercicios 1 al 182 del cuadernillo. Sólo deberán hacerla los alumnos que no hayan recuperado la materia en las pruebas anteriores.
En caso de no superar la materia con estas pruebas, los alumnos y alumnas podrán acudir a la convocatoria extraordinaria con una prueba de suficiencia. El criterio que se adopte para elaborar y calificar dicha prueba tendrá como base los criterios de evaluación establecidos en esta programación de Física y Química de 3º de E.S.O.
Cuadernillo de ejercicios.
En caso de duda, consultar con Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
- Detalles
- Escrito por Jesús Benayas
- Categoría: Física y Química de 3º E.S.O.
- Visto: 11359
Aquí os dejo unos enlaces que pueden resultar interesantes para el estudio de esta unidad didáctica.
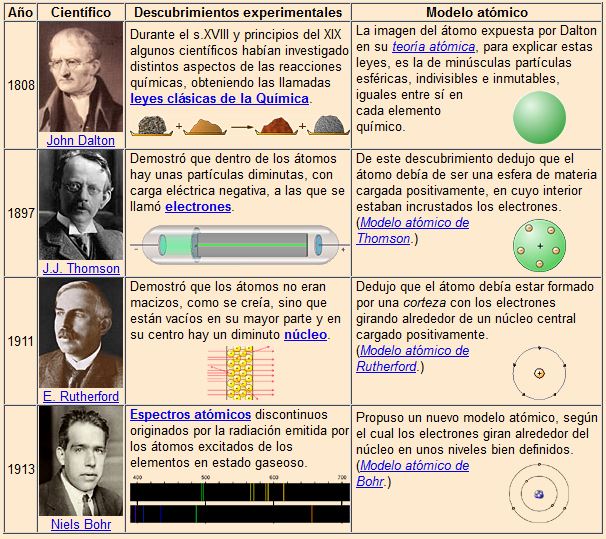
Primeros modelos atómicos.
Para repasar los modelos atómicos tenéis un enlace al material elaborado por Mariano Gaite Cuesta y premiado por el CNICE.
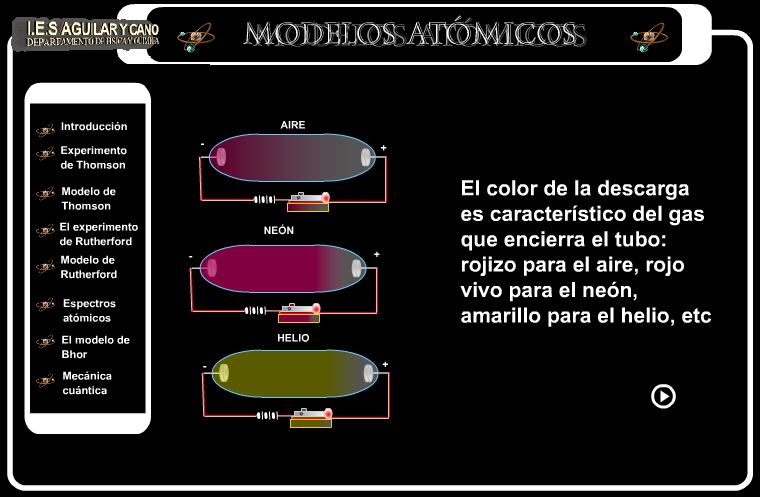
O a la presentación Flash del I.E.S. Aguilar y Cano
Especialmente interesante la explicación del experimento de Thomson.
Crookes Tube: Cathode Rays
En el enlace de abajo tenéis un applet java para visualizar la dispersión en el experimento de Rutherford.
Y aquí tenéis otro applet java para lo mismo.
El experimento de Rutherford.
Construir un átomo
Espectros atómicos.
En este applet podemos apreciar los espectros de emisión y absorción de los distintos átomos del sistema periódico.
En este enlace tenemos un applet similar al anterior.
Los modelos atómicos de Thomson y Rutherford no pueden explicar los espectros de emisión y absorción de los átomos, por eso Bohr propone un nuevo modelo.
Orbitales atómicos
Orbital atómico es la zona del espacio donde existe una gran probabilidad de encontrar el electrón. Para poder representar esa zona mediante un contorno se suele tomar arbitrariamente un valor de probabilidad del 90 %.
Desaparece el concepto de órbita del modelo de Rutherford como trayectoria definida, con energías y posiciones del electrón perfectamente determinadas.
-
Números cuánticos
La distribución de los electrones en el hidrógeno y otros átomos viene dada en función de los anteriores orbitales. Cada uno de ellos viene definido por tres números cuánticos: el número cuántico principal, el número cuántico del momento angular y el número cuántico magnético.
Estos números se utilizan, no sólo para describir los orbitales atómicos, sino también para identificar a los electrones que están en ellos.
Existe un cuarto número cuántico, el número cuántico (de espín), que completa la descripción de los electrones en los átomos.
El número cuántico principal (n)
El número cuántico principal (“n”) puede tomar valores enteros: 1, 2, 3, etc... El número cuántico principal se relaciona con la distancia promedio del electrón al núcleo en un orbital y con la energía de este.
El número cuántico secundario (l)
El número cuántico secundario (“l”) está relacionado con la forma de los orbitales y también, junto al número cuántico principal, aunque en menor medida, con la energía de estos. Los valores de “l” dependen del valor del número cuántico principal “n”. Para cierto valor de “n”, “l” puede tener cualquier valor entero desde 0 hasta (n - 1). Para “n” = 1, sólo existe un posible valor “l”=0; para “n” = 2, “l” puede tener dos valores: 0 y 1. Si “n” = 3, “l” puede tener tres valores: 0, 1 y 2.
A cada valor de “l”= 0, 1, 2, 3,… se le designa con las letras s, p, d, f,... respectivamente. Por lo tanto, si “l”= 0, tenemos un orbital s, si “l”= 1, tenemos un orbital p, y así sucesivamente.
El conjunto de orbitales que tienen el mismo valor de “n” se conoce comúnmente como nivel o capa. Los orbitales que tienen los mismos valores de “n” y “l”, se conocen como subnivel o subcapa. Así, el nivel con “n”=2 está formado de dos subniveles, “l”=0, “l”=1. Normalmente nos referimos a ellos como subniveles 2s y 2p, donde el 2 es el valor de “n” “s” o “p” representa el valor de “l”.
El número cuántico magnético (m)
El número cuántico magnético “m” describe la orientación del orbital en el espacio. Dentro de un subnivel, el valor de “m” depende del valor que tenga el número cuántico secundario “l”. Para cada valor de “l” existen (2·“l”+1) valores enteros de “m”, desde –“l” hasta +“l” pasando por el cero:
Si “l”=0, entonces “m”=0. Si “l”=1, entonces existen tres valores de “m” que son -1, 0 y 1. Si “l”=2, hay cinco valores de “m”, -2, -1, 0, 1 y 2. El número de valores de “m” indica el número de orbitales presentes en un subnivel con cierto valor de “l”.
Por ejemplo para un valor de “n”=4 (nivel 4), y un valor de “l”=3 (subnivel “f”), tendría siete orbitales diferentes (uno por cada valor de “m”). Así, cada orbital viene definido por los valores de los tres primeros números cuánticos.
El número cuántico de spin (s)
cada electrón en el átomo viene definido por los valores de los tres números cuánticos anteriores. “n”, “l” y “m” que son los mismos que definen el orbital que ocupa y además por el valor de un cuarto número cuántico “s” llamado de spin. Este está relacionado con el giro del electrón sobre sí mismo. El número cuántico de spin puede tomar los valores “s”=+½ y “s”=-½.
Tabla resumen
|
NÚMERO CUÁNTICO |
VALORES POSIBLES |
SIGNIFICADO |
|
|---|---|---|---|
|
n |
Principal |
1, 2, 3, … |
Nivel de energía |
|
l |
Secundario |
0, …, (n-1) |
Subnivel de energía Tipo de orbital |
|
m |
Magnético |
-l,…, 0, …, +l |
Orientación del orbital |
|
s |
Spin |
+½, -½ |
"Giro" del electrón |
-
Tipos de orbitales.
Los orbitales pueden tener formas muy diferentes. Como hemos visto esta forma viene definida por los valores del número cuántico “l”.
Para “l”=0, tenemos los orbitales de tipo “s”, que tienen simetría esférica. Aunque la forma es prácticamente la misma para todos los orbitales de tipo “s”, el radio crece con el valor del número cuántico “n” (nivel de energía).
Para “l”=1, tenemos los tres orbitales de tipo “p”, uno dirigido según el eje y, otro según el eje z y el tercero según el eje x. Tienen simetría de revolución y se nombran px, py y pz, según los ejes sobre los que se orientan.
Para “l”=2, tenemos los cinco orbitales de tipo “d”, de formas complicadas y dirigido según varios ejes. La parte que se proyecta sobre cada eje tiene simetría de revolución y se nombran , según los ejes sobre los que se orientan.
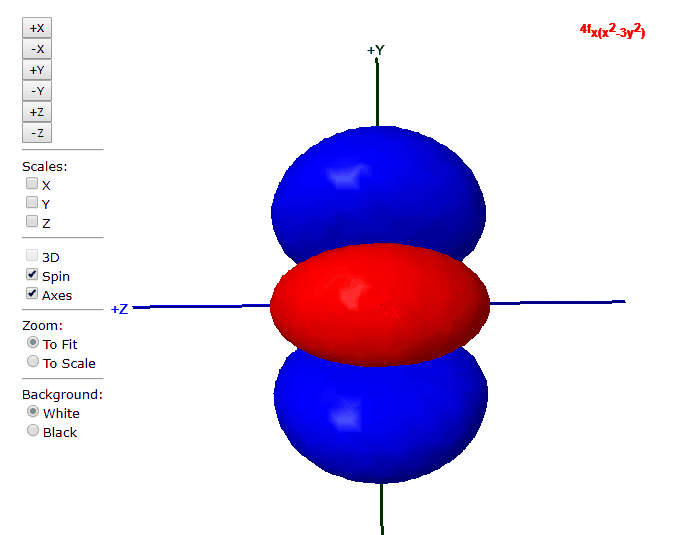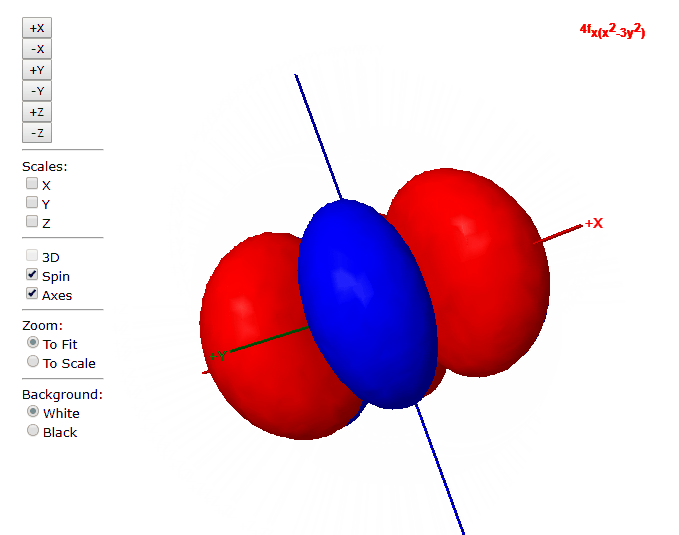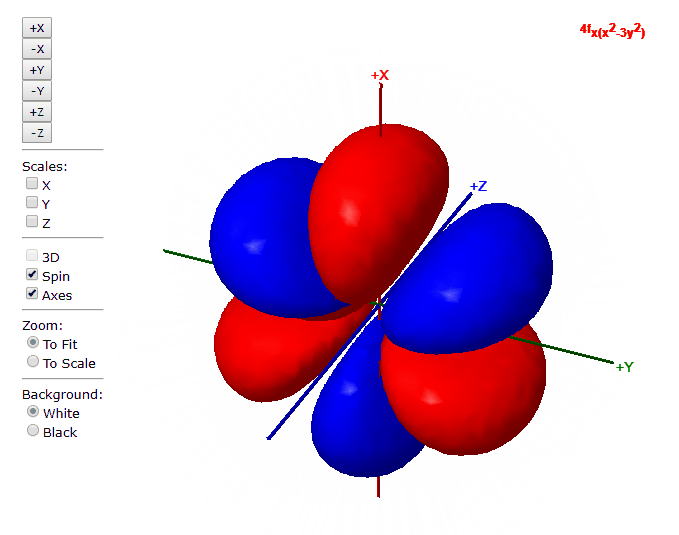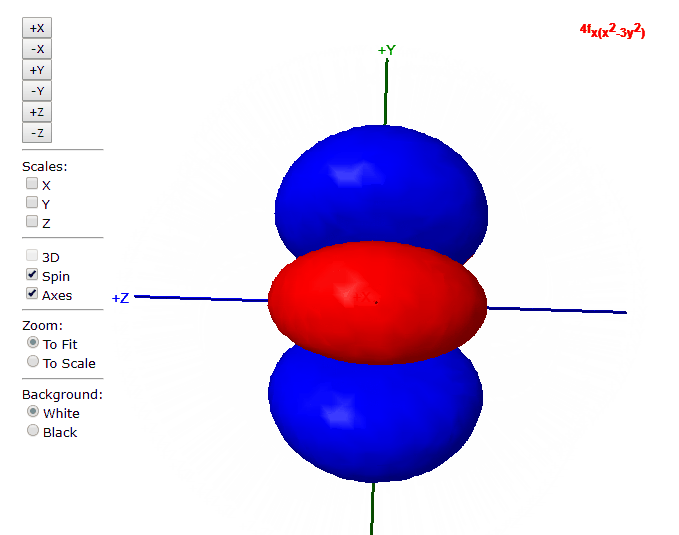
Para “l”=3, tenemos los siete orbitales de tipo “f”, con formas más complicadas que podremos ver en el applet de debajo
Applet para visualizar orbitales atómicos
Applet para visualizar orbitales atómicos
En este applet podemos apreciar los orbitales atómicos del átomo de hidrógeno.
En estos enlaces tenemos applets similares:
TU GrazGraz University of Technology
En este otro applet también podemos apreciar los orbitales atómicos del átomo de hidrógeno. ¡OJO no funciona en Chrome!.
Estructura electrónica de los átomos.
Cada electrón, en un átomo, queda identificado por cuatro números cuánticos, que suelen abreviarse como (n, l, m, s). De esta manera el electrón (2, 0, 0,+½) será un electrón situado en el orbital definido por los números cuánticos n=2, l=0 y m=0; además tendrá un spin s=+½.
Si indicamos los valores de los números cuánticos de cada electrón del átomo, tendremos definida su estructura electrónica, pero normalmente se abrevian estos datos o se representan esquemáticamente.
Es frecuente indicar solamente cuántos electrones pertenecientes al átomo hay en cada capa y subcapa energética de este. Esta distribución ordenada se denomina configuración electrónica. Así la configuración electrónica del helio sería 1s2, donde 1 indica la capa o nivel (n=1), s indica el subnivel (l=0) y el superíndice indica el número de electrones en el subnivel (hay dos electrones en el subnivel 1s)
hay una serie de reglas y consideraciones que nos permiten deducir las diferentes configuraciones electrónicas de los átomos con varios electrones:
-
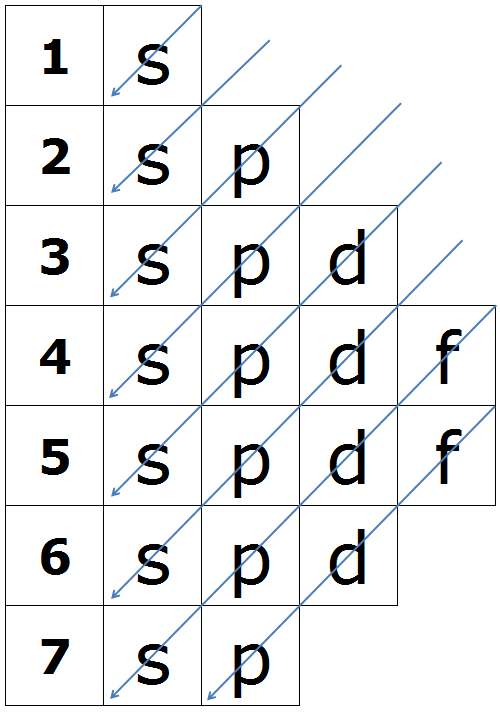
Orden energético de los orbitales.
Los electrones entran en los distintos orbitales por estricto orden de energías. El orden de llenado (energías crecientes) es el indicado en el diagrama de Moeller.
-
Principio de exclusión de Pauli.
No es posible que dos electrones de un mismo átomo tengan los cuatro valores de los números cuánticos iguales.
O sea: si dos electrones están en el mismo orbital atómico deben tener distintos valores del número cuántico de spin. Es decir, en el mismo orbital atómico sólo puede haber un máximo de dos electrones, que además deben tener espines opuestos.
-
Regla de máxima multiplicidad de Hund
Si en un mismo subnivel hay disponibles varios orbitales, los electrones se colocan de modo que ocupan el mayor número de ellos (desapareados), y además, con espines iguales o paralelos.
-
Principio de construcción (Aufbau)
La configuración electrónica de un átomo de un elemento químico (de número atómico Z), se puede construir a partir del anterior (número atómico Z-1), añadiendo un electrón (electrón diferenciador). Para ello se van añadiendo electrones siguiendo el orden energético (1), respetando el principio de exclusión de Pauli (2) y verificando la regla de máxima multiplicidad de Hund (3).
Actividad 1
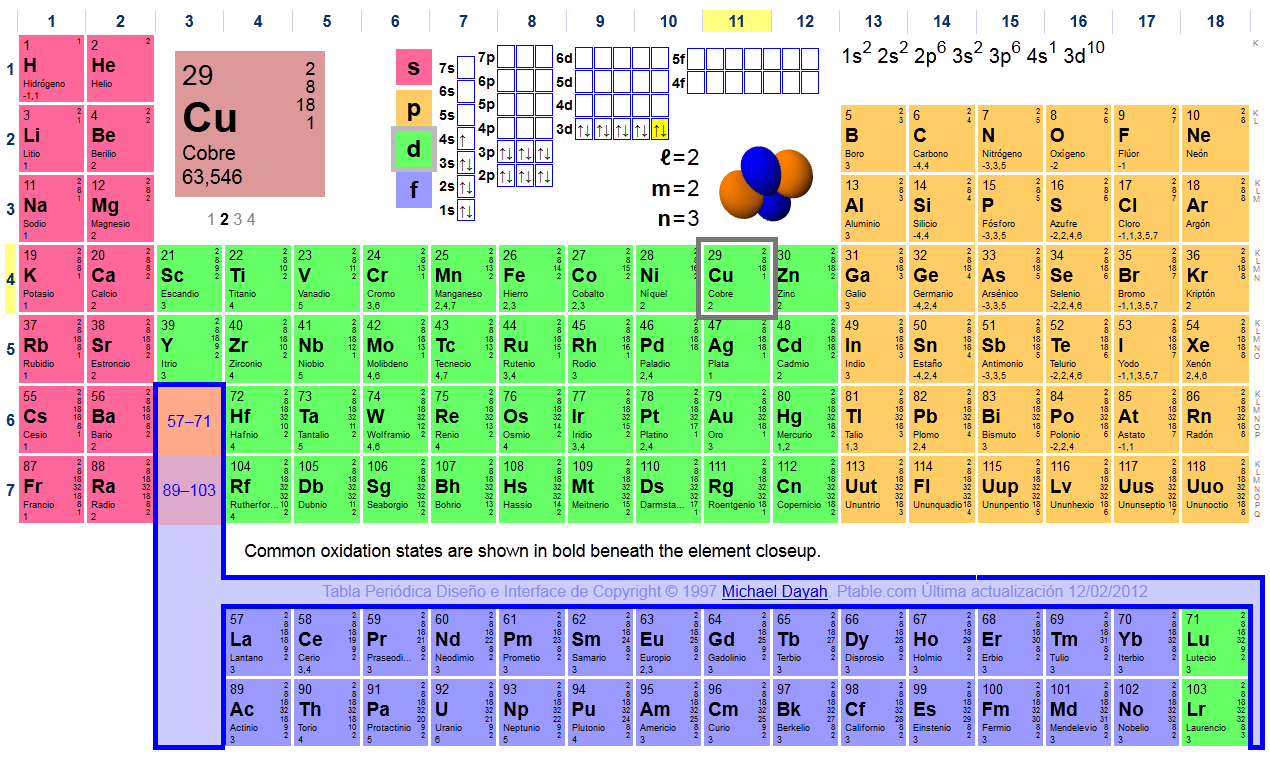
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: F (Z=9), Mg (Z=12), Cr (Z=24), Cu (Z=29)
Solución:
Actividad 2
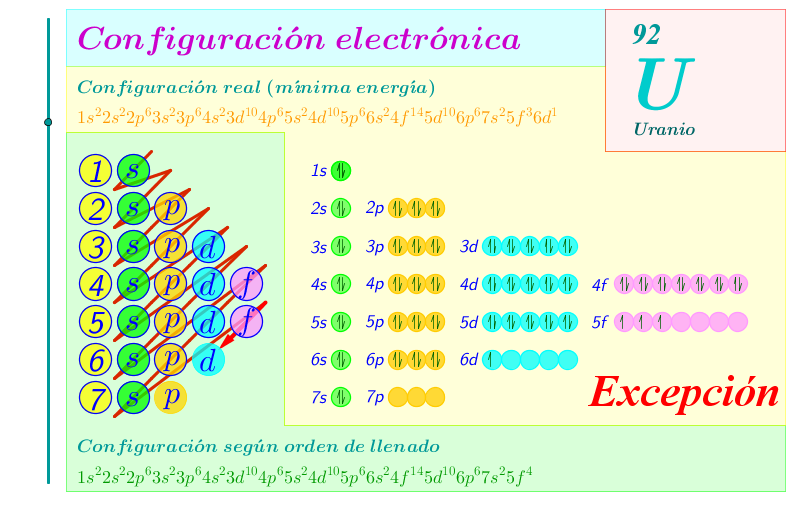
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: Ra (Z=88), U (Z=92), Au (Z=79), Po (Z=84)
Solución:
Applet para comprobar la configuración electrónica
Partículas de los átomos e iones.
atomTIC
Para profesores.
- Detalles
- Escrito por Jesús Benayas
- Categoría: Física y Química de 3º E.S.O.
- Visto: 7308
Tabla periódica. Elementos con números de oxidación.
Los elementos que aparecen remarcados en esta tabla periódica son los que debéis estudiar (como mínimo). Os puedo preguntar: nombre, símbolo y números de oxidación.
Aquí os dejo unos enlaces que pueden resultar interesantes para el estudio de esta unidad didáctica.
Tabla periódica
Aquí tenéis una de las tablas periódicas más completas de la red.
ENLACES ENTRE ÁTOMOS
Existen muchas más páginas con buenos contenidos, pero creo que con estas tenéis bastante de momento.
- Detalles
- Escrito por Jesús Benayas
- Categoría: Física y Química de 3º E.S.O.
- Visto: 8177
ENLACES EXTERNOS
Aquí os dejo unos enlaces que pueden resultar interesantes para el estudio de este tema.
Para repasar el modelo de Dalton podéis hacer click en el enlace de abajo.
Existen muchas más páginas con buenos contenidos, pero creo que con estas tenéis bastante de momento.