Aquí os dejo unos enlaces que pueden resultar interesantes para el estudio de esta unidad didáctica.
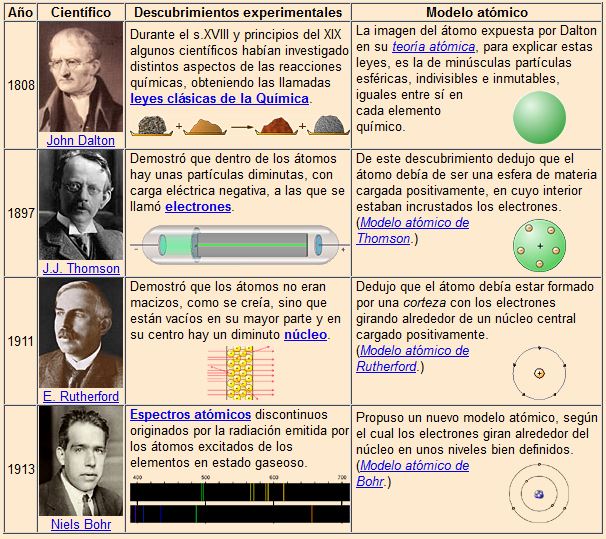
Primeros modelos atómicos.
Para repasar los modelos atómicos tenéis un enlace al material elaborado por Mariano Gaite Cuesta y premiado por el CNICE.
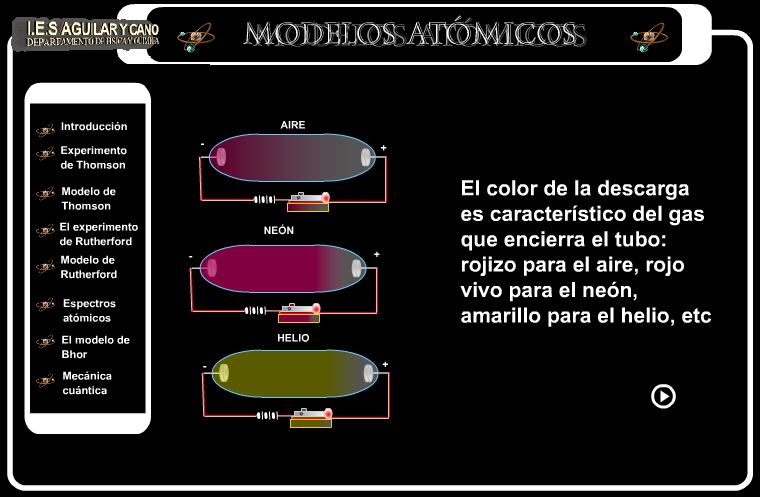
O a la presentación Flash del I.E.S. Aguilar y Cano
Especialmente interesante la explicación del experimento de Thomson.
Crookes Tube: Cathode Rays
En el enlace de abajo tenéis un applet java para visualizar la dispersión en el experimento de Rutherford.
Y aquí tenéis otro applet java para lo mismo.
El experimento de Rutherford.
Construir un átomo
Espectros atómicos.
En este applet podemos apreciar los espectros de emisión y absorción de los distintos átomos del sistema periódico.
En este enlace tenemos un applet similar al anterior.
Los modelos atómicos de Thomson y Rutherford no pueden explicar los espectros de emisión y absorción de los átomos, por eso Bohr propone un nuevo modelo.
Orbitales atómicos
Orbital atómico es la zona del espacio donde existe una gran probabilidad de encontrar el electrón. Para poder representar esa zona mediante un contorno se suele tomar arbitrariamente un valor de probabilidad del 90 %.
Desaparece el concepto de órbita del modelo de Rutherford como trayectoria definida, con energías y posiciones del electrón perfectamente determinadas.
-
Números cuánticos
La distribución de los electrones en el hidrógeno y otros átomos viene dada en función de los anteriores orbitales. Cada uno de ellos viene definido por tres números cuánticos: el número cuántico principal, el número cuántico del momento angular y el número cuántico magnético.
Estos números se utilizan, no sólo para describir los orbitales atómicos, sino también para identificar a los electrones que están en ellos.
Existe un cuarto número cuántico, el número cuántico (de espín), que completa la descripción de los electrones en los átomos.
El número cuántico principal (n)
El número cuántico principal (“n”) puede tomar valores enteros: 1, 2, 3, etc... El número cuántico principal se relaciona con la distancia promedio del electrón al núcleo en un orbital y con la energía de este.
El número cuántico secundario (l)
El número cuántico secundario (“l”) está relacionado con la forma de los orbitales y también, junto al número cuántico principal, aunque en menor medida, con la energía de estos. Los valores de “l” dependen del valor del número cuántico principal “n”. Para cierto valor de “n”, “l” puede tener cualquier valor entero desde 0 hasta (n - 1). Para “n” = 1, sólo existe un posible valor “l”=0; para “n” = 2, “l” puede tener dos valores: 0 y 1. Si “n” = 3, “l” puede tener tres valores: 0, 1 y 2.
A cada valor de “l”= 0, 1, 2, 3,… se le designa con las letras s, p, d, f,... respectivamente. Por lo tanto, si “l”= 0, tenemos un orbital s, si “l”= 1, tenemos un orbital p, y así sucesivamente.
El conjunto de orbitales que tienen el mismo valor de “n” se conoce comúnmente como nivel o capa. Los orbitales que tienen los mismos valores de “n” y “l”, se conocen como subnivel o subcapa. Así, el nivel con “n”=2 está formado de dos subniveles, “l”=0, “l”=1. Normalmente nos referimos a ellos como subniveles 2s y 2p, donde el 2 es el valor de “n” “s” o “p” representa el valor de “l”.
El número cuántico magnético (m)
El número cuántico magnético “m” describe la orientación del orbital en el espacio. Dentro de un subnivel, el valor de “m” depende del valor que tenga el número cuántico secundario “l”. Para cada valor de “l” existen (2·“l”+1) valores enteros de “m”, desde –“l” hasta +“l” pasando por el cero:
Si “l”=0, entonces “m”=0. Si “l”=1, entonces existen tres valores de “m” que son -1, 0 y 1. Si “l”=2, hay cinco valores de “m”, -2, -1, 0, 1 y 2. El número de valores de “m” indica el número de orbitales presentes en un subnivel con cierto valor de “l”.
Por ejemplo para un valor de “n”=4 (nivel 4), y un valor de “l”=3 (subnivel “f”), tendría siete orbitales diferentes (uno por cada valor de “m”). Así, cada orbital viene definido por los valores de los tres primeros números cuánticos.
El número cuántico de spin (s)
cada electrón en el átomo viene definido por los valores de los tres números cuánticos anteriores. “n”, “l” y “m” que son los mismos que definen el orbital que ocupa y además por el valor de un cuarto número cuántico “s” llamado de spin. Este está relacionado con el giro del electrón sobre sí mismo. El número cuántico de spin puede tomar los valores “s”=+½ y “s”=-½.
Tabla resumen
|
NÚMERO CUÁNTICO |
VALORES POSIBLES |
SIGNIFICADO |
|
|---|---|---|---|
|
n |
Principal |
1, 2, 3, … |
Nivel de energía |
|
l |
Secundario |
0, …, (n-1) |
Subnivel de energía Tipo de orbital |
|
m |
Magnético |
-l,…, 0, …, +l |
Orientación del orbital |
|
s |
Spin |
+½, -½ |
"Giro" del electrón |
-
Tipos de orbitales.
Los orbitales pueden tener formas muy diferentes. Como hemos visto esta forma viene definida por los valores del número cuántico “l”.
Para “l”=0, tenemos los orbitales de tipo “s”, que tienen simetría esférica. Aunque la forma es prácticamente la misma para todos los orbitales de tipo “s”, el radio crece con el valor del número cuántico “n” (nivel de energía).
Para “l”=1, tenemos los tres orbitales de tipo “p”, uno dirigido según el eje y, otro según el eje z y el tercero según el eje x. Tienen simetría de revolución y se nombran px, py y pz, según los ejes sobre los que se orientan.
Para “l”=2, tenemos los cinco orbitales de tipo “d”, de formas complicadas y dirigido según varios ejes. La parte que se proyecta sobre cada eje tiene simetría de revolución y se nombran , según los ejes sobre los que se orientan.
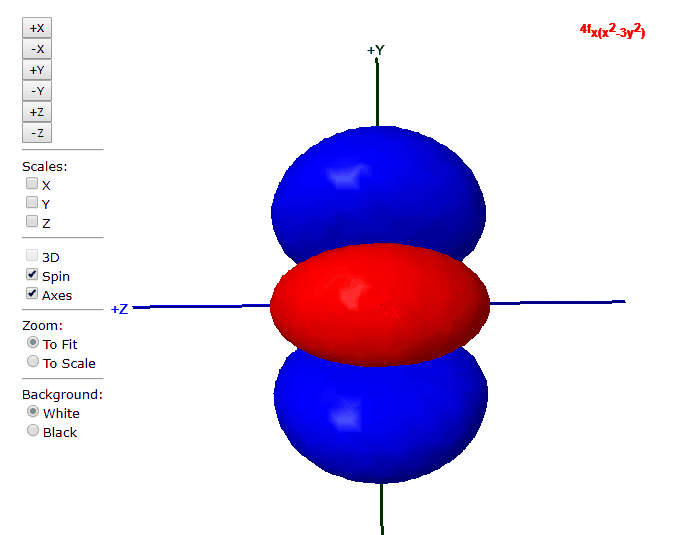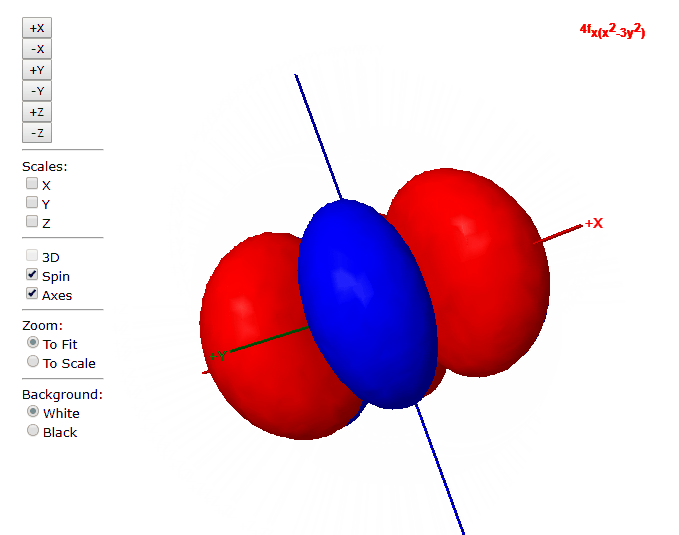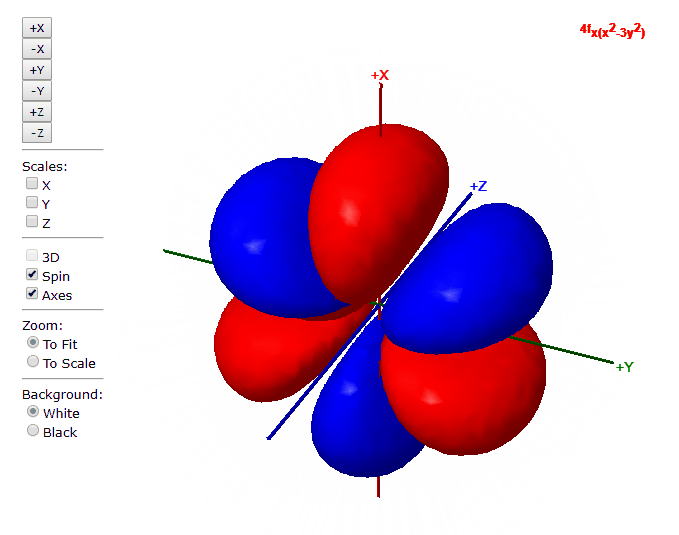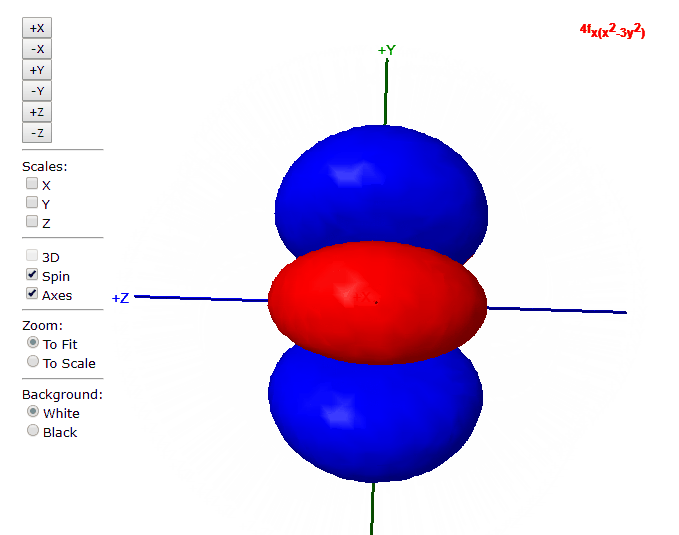
Para “l”=3, tenemos los siete orbitales de tipo “f”, con formas más complicadas que podremos ver en el applet de debajo
Applet para visualizar orbitales atómicos
Applet para visualizar orbitales atómicos
En este applet podemos apreciar los orbitales atómicos del átomo de hidrógeno.
En estos enlaces tenemos applets similares:
TU GrazGraz University of Technology
En este otro applet también podemos apreciar los orbitales atómicos del átomo de hidrógeno. ¡OJO no funciona en Chrome!.
Estructura electrónica de los átomos.
Cada electrón, en un átomo, queda identificado por cuatro números cuánticos, que suelen abreviarse como (n, l, m, s). De esta manera el electrón (2, 0, 0,+½) será un electrón situado en el orbital definido por los números cuánticos n=2, l=0 y m=0; además tendrá un spin s=+½.
Si indicamos los valores de los números cuánticos de cada electrón del átomo, tendremos definida su estructura electrónica, pero normalmente se abrevian estos datos o se representan esquemáticamente.
Es frecuente indicar solamente cuántos electrones pertenecientes al átomo hay en cada capa y subcapa energética de este. Esta distribución ordenada se denomina configuración electrónica. Así la configuración electrónica del helio sería 1s2, donde 1 indica la capa o nivel (n=1), s indica el subnivel (l=0) y el superíndice indica el número de electrones en el subnivel (hay dos electrones en el subnivel 1s)
hay una serie de reglas y consideraciones que nos permiten deducir las diferentes configuraciones electrónicas de los átomos con varios electrones:
-
Orden energético de los orbitales.
Los electrones entran en los distintos orbitales por estricto orden de energías. El orden de llenado (energías crecientes) es el indicado en el diagrama de Moeller.
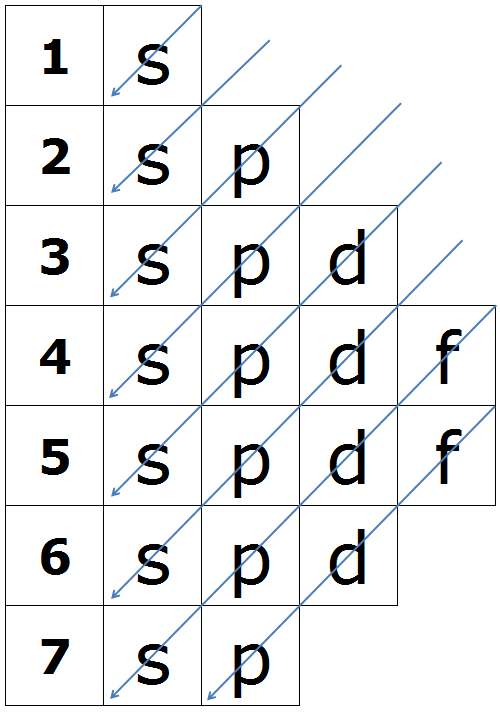
-
Principio de exclusión de Pauli.
No es posible que dos electrones de un mismo átomo tengan los cuatro valores de los números cuánticos iguales.
O sea: si dos electrones están en el mismo orbital atómico deben tener distintos valores del número cuántico de spin. Es decir, en el mismo orbital atómico sólo puede haber un máximo de dos electrones, que además deben tener espines opuestos.
-
Regla de máxima multiplicidad de Hund
Si en un mismo subnivel hay disponibles varios orbitales, los electrones se colocan de modo que ocupan el mayor número de ellos (desapareados), y además, con espines iguales o paralelos.
-
Principio de construcción (Aufbau)
La configuración electrónica de un átomo de un elemento químico (de número atómico Z), se puede construir a partir del anterior (número atómico Z-1), añadiendo un electrón (electrón diferenciador). Para ello se van añadiendo electrones siguiendo el orden energético (1), respetando el principio de exclusión de Pauli (2) y verificando la regla de máxima multiplicidad de Hund (3).
Actividad 1
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: F (Z=9), Mg (Z=12), Cr (Z=24), Cu (Z=29)
Solución:
Actividad 2
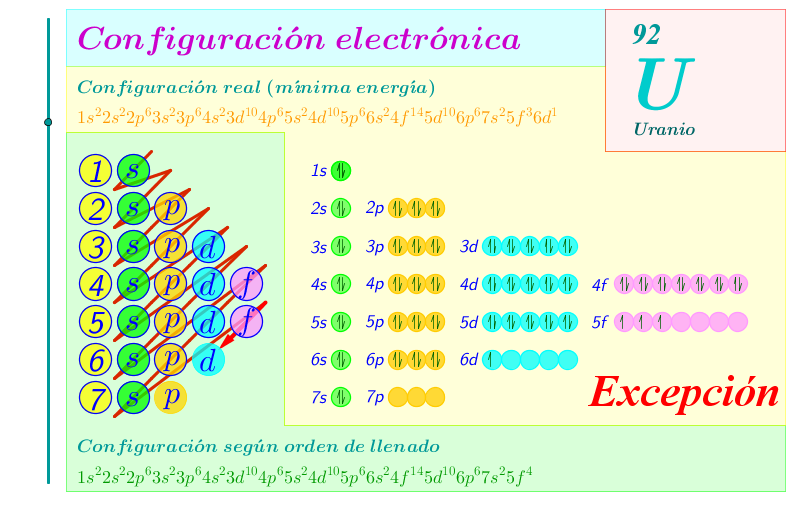
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: Ra (Z=88), U (Z=92), Au (Z=79), Po (Z=84)
Solución:
Applet para comprobar la configuración electrónica
Partículas de los átomos e iones.
atomTIC
Para profesores.