1. Introducción
Las sustancias químicas están formadas por agrupaciones de átomos; incluso las últimas partículas de las sustancias simples como el hidrógeno (H2) o el oxígeno (O2) están formadas por la unión de varios átomos, solo los gases nobles están en la naturaleza como átomos aislados. El enlace químico es el responsable de la unión estable entre dos o más átomos.
Todos los sistemas físicos tienden a alcanzar el estado de mínima energía, los átomos se unen con la misma finalidad, formar sustancias con menor energía que la que tendrían los átomos por separado. En este proceso intervienen fuerzas de origen electrostático, tanto de atracción como de repulsión, que ocasionan que los electrones de las capas más externas de los átomos se redistribuyan en sus nuevas localizaciones.
En esta animación se aprecia como funciona el pozo de potencial.
Aquí vemos la curva de estabilidad energética que muestra la variación de energía que experimenta un sistema formado por dos átomos en función de la distancia que los separa. En ella se observa que para la distancia internuclear (Re), denominada distancia de enlace o radio de enlace el sistema es más estable, pues predominan las fuerzas atractivas sobre las repulsivas.
De la configuración electrónica de la capa más externa, depende el tipo de enlace que forman los átomos. Los electrones que se sitúan en esa capa se conocen como electrones de valencia. Lewis toma como modelo de estabilidad a los gases nobles que presentan una distribución electrónica con los orbitales s y p del último nivel llenos (ns2 np6).
Los átomos tienden a captar, a ceder o a compartir electrones hasta quedar rodeados de ocho electrones de valencia.
Para destacar los electrones de valencia, usa diagramas de puntos de Lewis, en los que se dibujan rodeando el símbolo del elemento tantos puntos como electrones posea en la última capa. Aquí vemos los diagramas de puntos de los elementos del segundo periodo:
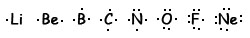
En cualquier caso la formación espontánea de un enlace manifiesta la tendencia de cada átomo a alcanzar la configuración electrónica más estable posible, la de menor energía.
2. Enlace iónico
2.1. Estructura del enlace iónico
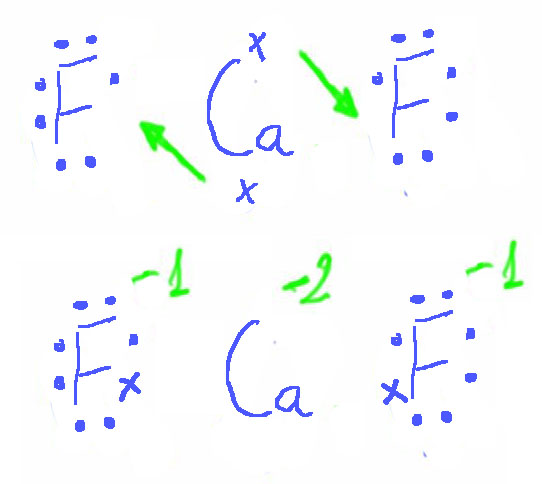
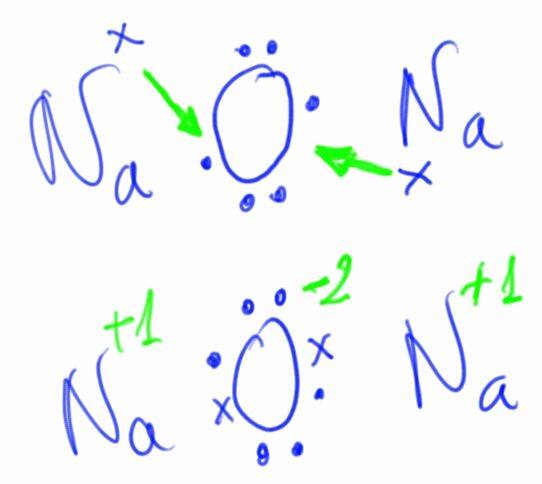
Cuando se unen un elemento muy electropositivo (metal) con otro muy electronegativo (no metal) se forma entre ellos un enlace iónico. Este consiste en una transferencia de uno o varios electrones del átomo del elemento metálico al no metálico, formándose dos iones que se unen por atracción electrostática.
Podemos representar la reacción mediante un diagrama de puntos:
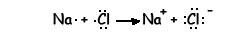
El sodio y el cloro han conseguido alcanzar la estructura electrónica de gas noble.
|
Na 1s2 2s2 2p6 3s1 |
Cl 1s2 2s2 2p6 3s2 3p5 |
|
Na+ 1s2 2s2 2p6 |
Cl- 1s2 2s2 2p6 3s2 3p6 |

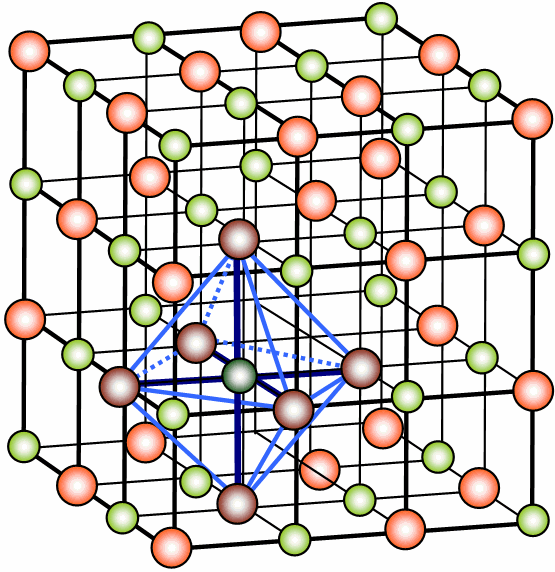
2.2. Redes cristalinas
El cristal del que hablamos antes está formado por iones de signo opuesto unidos entre si por fuerzas electrostáticas que hacen que cada uno se rodee de iones de carga opuesta. En condiciones ordinarias los compuestos iónicos son sólidos, los iones positivos (Na+) y negativos (Cl-) están prácticamente en contacto y se hallan dispuestos en posiciones fijas formando una estructura ordenada que se extiende indefinidamente en el espacio, formando retículos cristalinos o redes espaciales.
2.3. Propiedades de los compuestos iónicos
Los cristales iónicos tienen están formados por aniones y cationes que se unen debido a las fuerzas de electrostáticas, estos iones suelen ser de distinto tamaño y pueden tener distintas cargas, lo que da como resultado distintas estructuras reticulares.
Las propiedades de los compuestos iónicos se explican en función de su estructura y de las intensas fuerzas eléctricas existentes entre los iones positivos y los negativos.
A temperatura ambiente, los compuestos iónicos son sólidos. Sus temperaturas de fusión y ebullición son altas o muy altas, debido a la gran intensidad de las fuerzas electrostáticas entre iones de carga opuesta.
Los cristales iónicos suelen ser duros (cuesta rayarlos) debido a la gran intensidad de las fuerzas electrostáticas de atracción.
Los sólidos iónicos son frágiles. Si se aplica una fuerza sobre el material, las capas de los iones se deslizan y los de igual signo quedan enfrentados y se repelen, de modo que el cristal se rompe (no puede deformarse).
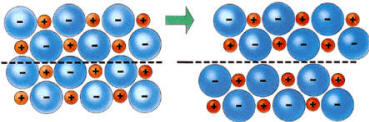
Muchos compuestos iónicos son solubles en disolventes polares como el agua. Las moléculas polares presentan separación de cargas, de forma que una parte de ellas es positiva y otra negativa. De este modo, en presencia de una sal, las moléculas polares del agua se disponen alrededor de los iones de la sal (proceso de solvatación) y ayudan a su dispersión.
Conductividad eléctrica
Los compuestos iónicos no conducen la electricidad en estado sólido debido a que los iones no pueden desplazarse, al ocupar posiciones fijas en la red. Por el contrario, sí conducen la electricidad en estado líquido o en disolución, pues en esos casos los iones tienen libertad para desplazarse.
3. Enlace covalente.
El enlace covalente entre dos átomos se origina cuando estos comparten electrones, completando su capa de valencia a 2 o a 8 e– (regla del octeto). Cada par de electrones compartido se considera un enlace y se representa con un guión largo.
Se produce entre átomos electronegativos (no metales). La mayoría de las sustancias que nos rodean (plástico, madera, agua, oxígeno, glucosa) tienen sus átomos unidos por este tipo de enlace.
Un enlace covalente consiste en la compartición de uno o más pares de electrones entre dos átomos, cumpliendo la regla del octeto. Estos electrones compartidos se sitúan entre los átomos, ejerciendo su atracción sobre ellos y manteniéndolos así unidos.
3.1. Estructuras de Lewis.
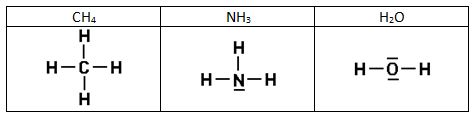
Para destacar los electrones de valencia, compartidos o no, se usan diagramas o estructuras de Lewis, en ellas cada átomo se indica con su símbolo rodeado de unos puntos que representan los electrones de valencia. Estos pueden aparecer también como cruces (para diferenciarlos de los del otro átomo) o como rayas (una raya representa un par de electrones)
Aquí tenéis las estructuras de Lewis de algunas sustancias:

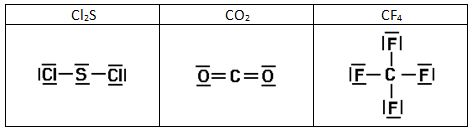
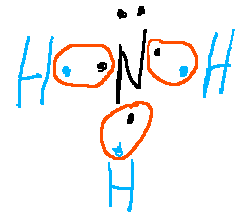
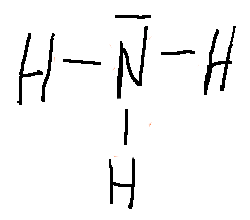
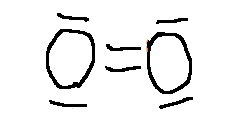
3.2. Propiedades de las sustancias covalentes
Entre las sustancias con enlaces covalentes podemos distinguir dos tipos, con estructura y propiedades muy diferentes.
a) Sustancias moleculares
Pertenecen a este grupo las sustancias constituidas por moléculas cuyos átomos están unidos por enlace covalente. Entre ellas hay sustancias que a temperatura ambiente suelen estar en forma gaseosa, sobre todo aquellas en las que el enlace es apolar (He, H2, O2, N2, CH4, NH3, HCl, SO2, NO2, etc...), en forma líquida (H2O, Br2, CH3-CH2OH, ClCH2-CH3, etc…) e incluso en estado sólido (I2, naftaleno, glucosa, etc…).
Propiedades físicas de las sustancias moleculares:
- Las temperaturas de fusión y de ebullición son bajas. En condiciones ordinarias, la mayoría de estas sustancias se encuentran en estado gaseoso como hemos indicado antes, otras son líquidas y las menos se encuentran en estado sólido. Estas últimas subliman con facilidad ya que la presión de vapor cerca del punto de fusión es muy elevada y en general funden por debajo de los 300 ºC. Esto se deriva de la debilidad de las fuerzas intermoleculares, una pequeña agitación térmica es suficiente para desordenar y separar las moléculas. Así se explican las bajas temperaturas de fusión y de ebullición.
- Suelen ser blandos, compresibles y fácilmente deformables. Esto se debe a la debilidad de las fuerzas intermoleculares.
- Las sustancias apolares son insolubles en disolventes polares como el agua, pero se disuelven bien en disolventes apolares como el tetracloruro de carbono. Las sustancias polares son más solubles en agua. Esto se debe a que la disolución sólo es posible si las fuerzas de atracción que ejercen las moléculas del soluto entre sí, y las moléculas del disolvente entre sí, pueden intercambiarse, lo que ocurre si son de la misma naturaleza y parecida intensidad.
- Las sustancias que forman cristales moleculares son, en general, buenos aislantes eléctricos. Esto se debe a que las moléculas no poseen carga eléctrica neta y, por tanto, no pueden transportar la carga como la transportan compuestos iónicos fundidos. Además, los electrones que forman los enlaces covalentes están fijos en sus orbitales moleculares lo que impide su desplazamiento, ello impide una conductividad similar a la de los metales.
b) Sustancias con red covalente (o reticulares)
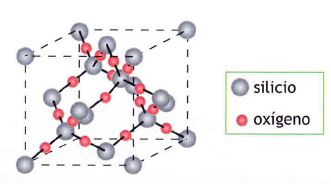
Por qué el CO2 es gaseoso en condiciones normales y el SiO2 es un sólido de gran dureza si son dióxidos de elementos contiguos de la misma familia. La razón es la diferente estructura de uno y otro. El dióxido de carbono está formado por moléculas discretas de CO2 y SiO2 forma una red cristalina covalente.
Cada átomo de silicio se dispone de forma tetraédrica rodeado de cuatro O. No hay moléculas individuales, un cristal de sílice es como una gigantesca molécula, ya que todos los átomos que lo constituyen están unidos entre sí por enlaces covalentes. El CO2 no puede tener estructura análoga pues el pequeño volumen del átomo de C le impide rodearse de cuatro átomos de 0, que estarían demasiado próximos entre sí y sufrirían la repulsión de sus nubes electrónicas.
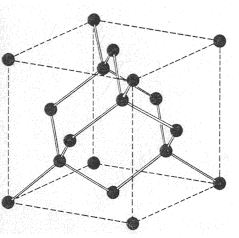
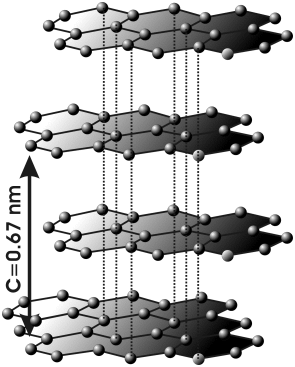
El carbono, en la variedad alotrópica diamante, muestra una estructura cristalina covalente, tetraédrica (hibridación sp3), muy parecida a la del Si02. Pero, en la variedad de grafito, el mismo carbono, muestra una estructura covalente en capas de hexágonos (hibridación sp2).
Suelen presentar estructuras con red covalente los elementos situados en la diagonal: B, C, Si, Ge, As, Sb, etc., de la tabla periódica.
Propiedades de las sustancias reticulares.
Tienen temperaturas de fusión muy elevadas (hasta 4000ºC en el diamante) ya que la fusión de un cristal atómico requiere la ruptura de un gran número de enlaces covalentes, muy fuertes.
Son muy duros e incompresibles, ya que los enlaces covalentes tienen direcciones fijas en función de la hibridación que se forme y cualquier deformación en sólidos como Si02, Si o C (diamante) implica la ruptura de múltiples enlaces covalentes, lo que requiere una gran cantidad de energía.
Son insolubles ya que su disolución requiere también la ruptura de gran cantidad de enlaces covalentes.
En general no conducen la electricidad, aunque hay algunas excepciones (el grafito puede conducir en las direcciones paralelas a los planos hexagonales)
4. Enlace metálico
4.1. Propiedades de los metales.
Las siguientes propiedades son comunes a todos los metales:
• Buenos conductores de la electricidad, tanto en estado sólido como fundidos. Un aumento de temperatura disminuye su conductividad eléctrica.
• Alta conductividad térmica.
• Densidades generalmente elevadas.
• Son dúctiles (se pueden alargar en hilos) y maleables (capaces de ser reducidos a láminas).
• Temperaturas de fusión y de ebullición relativamente elevadas. Todos los metales, salvo el mercurio, tienen temperaturas de fusión superiores a los 25ºC.
• Poseen brillo metálico.
• Son insolubles en agua y en disolventes orgánicos. Algunos metales reaccionan con el agua.
Se debe señalar que entre los propios metales existen grandes diferencias en cuanto a los valores de una determinada propiedad. Existen valores muy distintos cuando se comparan metales representativos con metales de transición.
4.2. Modelo de enlace metálico
Existen diversas teorías que tratan de dar explicación a la forma en que están unidos los átomos en los metales (y sus aleaciones) ya las propiedades más características de los mismos. En este curso solo veremos la siguiente:
Modelo del gas electrónico o del mar de electrones
Este modelo se basa en la suposición de que los metales están formados por la aglomeración de iones positivos bañados por un mar de electrones o sumergidos en un gas electrónico.
En esta situación, los electrones no pertenecen a los átomos individuales, sino que todos ellos son comunes al conjunto de los átomos que forman la red; es decir, están deslocalizados.
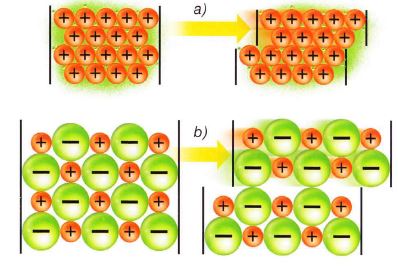
Esto explicaría su relativa facilidad para desplazarse por la estructura metálica, lo que produce las elevadas conductividades halladas y los efectos de emisión electrónica.
Esta teoría también justifica las especiales características de moldeo que tienen los metales (a) pues, al aplicar una fuerza, se produce un desplazamiento de las capas iónicas en las estructuras que no produce una variación importante en las mismas, por lo que no se rompen. En cambio, en el caso de cristales iónicos (b) se observa una gran inestabilidad de tipo electrostático por estos desplazamientos.