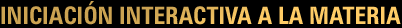Aquí os dejo unos enlaces que pueden resultar interesantes para el estudio de esta unidad didáctica.
Primeros modelos atómicos.
Para repasar el modelo de Dalton podéis hacer click en el enlace de abajo.
Para repasar los demás modelos tenéis un enlace al material:
Elaborado por Mariano Gaite Cuesta y premiado por el CNICE.
O a la presentación Flash del I.E.S. Aguilar y Cano
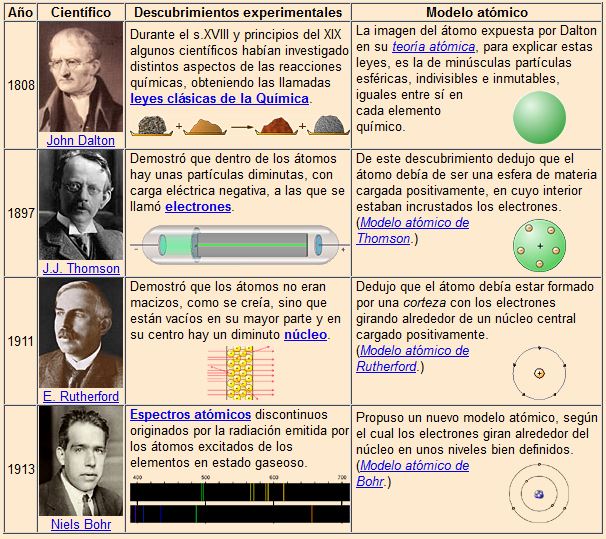
Especialmente interesante la explicación del experimento de Thomson.
Atom.- 1 The Clash of the Titans
Documental de la BBC sobre el descubrimiento de la estructura del átomo.
El profesor de Física Nuclear Jim Al-Khalili explica como se descubrió que todo está hecho de átomos y cómo el descubrimiento afectó al mundo científico.
En el enlace de abajo tenéis un applet java para visualizar la dispersión en el experimento de Rutherford.
Construir un átomo
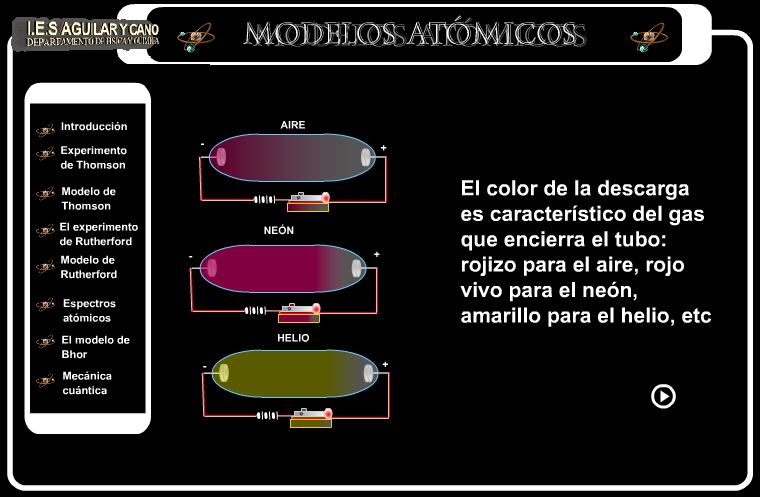
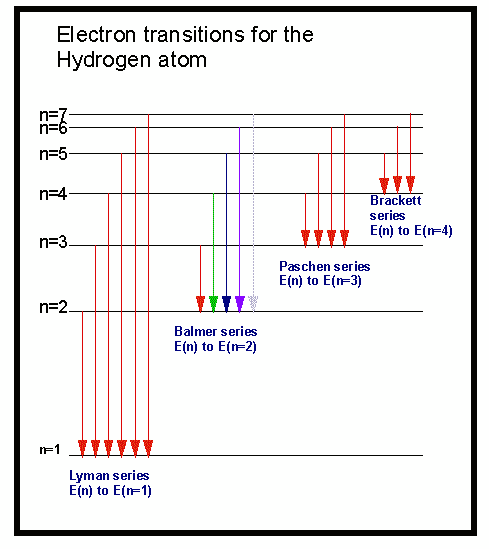
Espectros atómicos
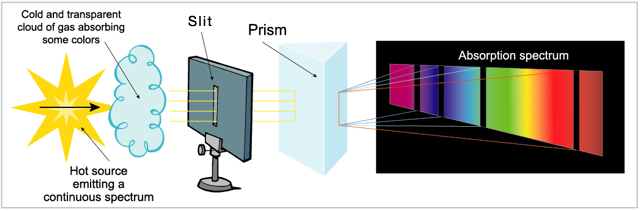
Al hacer incidir un haz de luz blanca sobre un prisma de vidrio, esta se descompone dando un espectro continuo, en cuyos extremos se disponen el violeta en uno y el rojo el menos desviado, en otro. Entre ambos se encuentran presentes todas las frecuencias de luz.

Cuando se produce una descarga eléctrica en un tubo de vacío que contiene hidrógeno, el gas se ilumina con una luz rojiza. Analizada esta luz con un aparato llamado espectroscopio, muestra un espectro discontinuo, formado por rayas luminosas de frecuencias definidas, separadas por zonas oscuras. Es el espectro atómico del hidrógeno.

Cualquier elemento en estado gaseoso, en las circunstancias anteriores, origina un espectro atómico propio y particular. Así, el sodio presenta en su espectro una línea amarilla muy característica, el rubidio produce una línea roja, etc…
Si el hidrógeno es iluminado por luz blanca absorbe la energía de las longitudes de onda que antes emitía, de manera que si luego hacemos pasar la luz por un prisma observamos una serie de líneas oscuras. Esto sería un espectro de absorción.
En este applet podemos apreciar los espectros de emisión y absorción de los distintos átomos del sistema periódico.
En este enlace tenemos un applet similar al anterior.
Los modelos atómicos de Thomson y Rutherford no pueden explicar los espectros de emisión y absorción de los átomos, por eso Bohr propone un nuevo modelo.
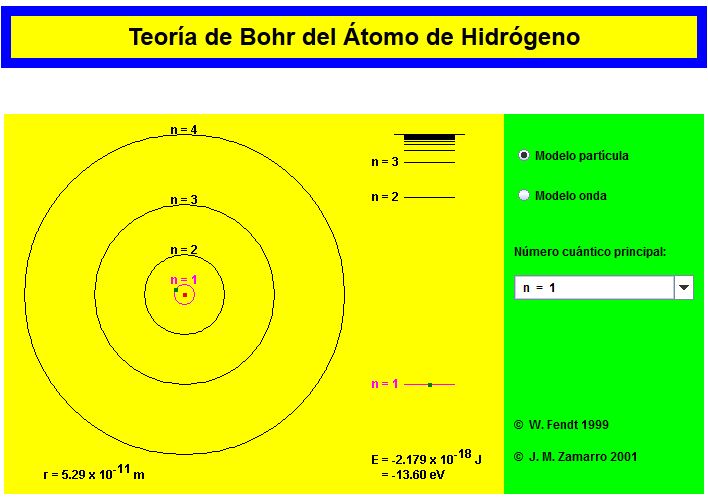
Modelo atómico de Bohr
El modelo de Rutherford no puede ser estable, ya que según la teoría del electromagnetismo de Maxwell las cargas aceleradas radian energía, y el electrón al girar alrededor del núcleo estará sometido a una aceleración centrípeta. Así el electrón debe perder energía e ir acercándose cada vez más al núcleo para terminar precipitándose sobre él.
Por otra parte el modelo de Rutherford tampoco explica los espectros atómicos, ya que el electrón al girar debería emitir un espectro continuo de energía.
En 1913 el danés Niels Bohr propone unas ideas revolucionarias para el átomo de hidrógeno apoyándose en otras recientes de Planck (para explicar la radiación del cuerpo negro) y Einstein (para explicar el efecto fotoeléctrico) y plantea su modelo atómico, que se basa en tres postulados:
-
Postulados de Bohr.
- El electrón gira alrededor del núcleo atómico permaneciendo únicamente sobre unas órbitas circulares bien definidas llamadas órbitas estacionarias. En esas órbitas el electrón tiene una energía bien definida y no puede perder energía por radiación debido a su movimiento acelerado. (La ley del electromagnetismo que propone la radiación de energía por las cargas aceleradas, carece de validez para las órbitas estacionarias).En este modelo la fuerza centrípeta que hace girar al electrón coincide con la fuerza de atracción electrostática.
- Las órbitas estacionarias permitidas son aquellas en las que el electrón tiene un momento angular (magnitud relacionada con el giro) múltiplo entero de la constante de Planck reducida. Introduce así el número cuántico "n" que puede tomar valores enteros (1,2,3…)
- Los electrones pueden saltar de unas órbitas estacionarias a otras. En esos saltos se producirá la absorción (salto a una órbita más alejada del núcleo) o emisión (salto a una órbita más cercana al núcleo) de fotones, cuya energía será la diferencia entre las energías de cada órbita y cuya frecuencia vendrá dada por la ecuación de Planck.
-
Explicación del espectro del hidrógeno
Applets sobre el modelo de Bohr
Applet de Walter Fendt
-
Fallos del modelo de Bohr
Pese a toda esta ampliación del modelo sólo pudo ser aplicado al átomo de hidrógeno y a iones con un solo electrón (como el He+).
El modelo de Bohr tampoco explicaba la diferencia de intensidad entre las distintas líneas espectrales ni muchos aspectos del enlace químico.
Por otra parte, se hacía notar que los tres postulados con los que Bohr desarrolló su modelo eran una mezcla de mecánica clásica e ideas cuánticas. Además, algunas propuestas (órbitas estacionarias, números cuánticos) estaban introducidas de manera arbitraria.
Aunque este modelo no es el que se acepta hoy día varias de sus ideas básicas, como las restricciones de energía y posición del electrón en el átomo y el mecanismo de emisión de luz por saltos del electrón, no han perdido vigencia y son recogidas en el modelo actual.
Mecánica cuántica.
La mecánica cuántica o mecánica ondulatoria, surge hacia 1925 como resultado del conjunto de trabajos realizados por Werner Heisenberg, Erwin Schrödinger, Paul Dirac y otros. Explica satisfactoriamente los espectros atómicos y la formación de los enlaces químicos.
La mecánica cuántica se basa en la teoría de Planck, y toma como punto de partida la hipótesis de la dualidad onda-corpúsculo de Louis De Broglie y el principio de incertidumbre de Heisenberg.
-
Hipótesis de Planck.
En el año 1900, Planck concibe la idea de que la emisión de radiación por parte de la materia no tiene lugar de manera continua, como suponía la física clásica, sino de manera discontinua, y establece: La luz es emitida por la materia en cantidades discretas e indivisibles llamadas cuantos, cuya energía es proporcional a la frecuencia f de la radiación emitida: E= hf , siendo h una constante cuyo valor es 6,624⋅10−34 J⋅s
-
Dualidad onda-corpúsculo (hipótesis de De Broglie)
¿Por qué el electrón sólo se mueve en ciertas órbitas? La respuesta la proporciona Louis De Broglie quien sugiere:
Al igual que la luz se puede comportar como una onda (difracción) o como una partícula (efecto fotoeléctrico), las partículas atómicas como los electrones también pueden comportarse como ondas, así los electrones se comportan en el átomo como ondas estacionarias.
La hipótesis se confirmó experimentalmente en 1927 al observarse la difracción de los electrones, fenómeno que sólo puede explicarse si los electrones se comportan como ondas.
-
Principio de incertidumbre o Indeterminación
En 1927, Heisenberg formuló su principio de incertidumbre, referido a las magnitudes cantidad de movimiento y posición. Dicho principio se puede enunciar así:
Es imposible conocer simultáneamente y con total exactitud la posición y el momento lineal de una partícula ya que el producto de sus imprecisiones siempre debe ser mayor que la constante reducida de Plank.
Ecuación de ondas de Schrödinger
Las ideas anteriormente expuestas, hipótesis de Planck, hipótesis de De Broglie, principio de incertidumbre, están presentes en formulación de la mecánica cuántica de Schrödinger. Basándose en la hipótesis de De Broglie considera que si el electrón puede comportarse como una onda, podemos describir su movimiento en el átomo utilizando la ecuación matemática de una onda.
La solución de la ecuación proporciona diversas funciones posibles, cada una de ellas con un valor determinado de la energía. Estas funciones dependen de ciertos números enteros (los mismos números cuánticos que aparecían en el modelo de Bohr).
Así superamos uno de los inconvenientes del modelo de Bohr, la cuantización de la energía y los números cuánticos son consecuencia de la ecuación, y no tienen que ser introducidos arbitrariamente para justificar los datos empíricos.
Orbitales atómicos
En la interpretación física de la función de onda se desecha el concepto tradicional de órbita (como trayectoria definida y con energías y posiciones del electrón perfectamente determinadas) y se sustituye por el de orbital atómico, definido de la siguiente manera:
Orbital atómico es la zona del espacio donde existe una gran probabilidad de encontrar el electrón. Para poder representar esa zona mediante un contorno se suele tomar arbitrariamente un valor de probabilidad del 90 %.
-
Números cuánticos
La distribución de los electrones en el hidrógeno y otros átomos viene dada en función de los anteriores orbitales. Cada uno de ellos viene definido por tres números cuánticos que se derivan de la solución matemática de la ecuación de Schrödinger para el átomo de hidrógeno y son: el número cuántico principal, el número cuántico del momento angular y el número cuántico magnético.
Estos números se utilizan, no sólo para describir los orbitales atómicos, sino también para identificar a los electrones que están en ellos.
Existe un cuarto número cuántico, el número cuántico de espín, que aparece cuando Dirac introduce los efectos relativistas en la ecuación de Schrödinger y que completa la descripción de los electrones en los átomos.
El número cuántico principal (n)
El número cuántico principal (“n”) puede tomar valores enteros: 1, 2, 3, etc... En el átomo de hidrógeno, el valor de n define la energía de un orbital junto al número cuántico secundario, y en mayor medida que este. El número cuántico principal también se relaciona con la distancia promedio del electrón al núcleo en determinado orbital. Cuanto más grande es el valor de “n”, mayor es la distancia entre un electrón en el orbital respecto del núcleo y, en consecuencia, el orbital es más grande.
El número cuántico secundario o azimutal (l)
El número cuántico secundario (“l”) está relacionado con la forma de los orbitales y también, junto al número cuántico principal, aunque en menor medida, con la energía de estos. Los valores de “l” dependen del valor del número cuántico principal “n”. Para cierto valor de “n”, “l” puede tener cualquier valor entero desde 0 hasta (n - 1). Para “n” = 1, sólo existe un posible valor “l”=0; para “n” = 2, “l” puede tener dos valores: 0 y 1. Si “n” = 3, “l” puede tener tres valores: 0, 1 y 2.
A cada valor de “l”= 0, 1, 2, 3, 4, 5,… se le designa con las letras s, p, d, f, g, h,... respectivamente. Por lo tanto, si “l”= 0, tenemos un orbital s, si “l”= 1, tenemos un orbital p, y así sucesivamente.
El conjunto de orbitales que tienen el mismo valor de “n” se conoce comúnmente como nivel o capa. Los orbitales que tienen los mismos valores de “n” y “l”, se conocen como subnivel o subcapa. Así, el nivel con “n”=2 está formado de dos subniveles, “l”=0, “l”=1. Normalmente nos referimos a ellos como subniveles 2s y 2p, donde el 2 es el valor de “n” “s” o “p” representa el valor de “l”.
El número cuántico magnético (m)
El número cuántico magnético “m” describe la orientación del orbital en el espacio. Dentro de un subnivel, el valor de “m” depende del valor que tenga el número cuántico secundario “l”. Para cada valor de “l” existen (2·“l”+1) valores enteros de “m”, desde –“l” hasta +“l” pasando por el cero:
Si “l”=0, entonces “m”=0. Si “l”=1, entonces existen tres valores de “m” que son -1, 0 y 1. Si “l”=2, hay cinco valores de “m”, -2, -1, 0, 1 y 2. El número de valores de “m” indica el número de orbitales presentes en un subnivel con cierto valor de “l”.
Por ejemplo para un valor de “n”=4 (nivel 4), y un valor de “l”=3 (subnivel “f”), tendría siete orbitales diferentes (uno por cada valor de “m”). Así, cada orbital viene definido por los valores de los tres primeros números cuánticos, sin tener en cuenta el valor del número cuántico de spin que veremos a continuación.
El número cuántico de spin (s)
Cada electrón en el átomo viene definido por los valores de los tres números cuánticos anteriores. “n”, “l” y “m” que son los mismos que definen el orbital que ocupa y además por el valor de un cuarto número cuántico “s” llamado de spin. Este está relacionado con el momento de giro del electrón sobre sí mismo, es decir con la posibilidad de que el minúsculo campo magnético del electrón se disponga en un sentido o en sentido contrario. El número cuántico de spin puede tomar los valores “s”=+½ y “s”=-½.
Tabla resumen
|
NÚMERO CUÁNTICO |
VALORES POSIBLES |
SIGNIFICADO |
|
|---|---|---|---|
|
n |
Principal |
1, 2, 3, … |
Nivel de energía |
|
l |
Secundario |
0, …, (n-1) |
Subnivel de energía Tipo de orbital |
|
m |
Magnético |
-l,…, 0, …, +l |
Orientación del orbital |
|
s |
Spin |
+½, -½ |
Momento magnético del electrón |
-
Tipos de orbitales.
Los orbitales pueden tener formas muy diferentes. Como hemos visto esta forma viene definida por los valores del número cuántico “l”.
Para “l”=0, tenemos los orbitales de tipo “s”, que tienen simetría esférica. Aunque la forma es prácticamente la misma para todos los orbitales de tipo “s”, el radio crece con el valor del número cuántico “n” (nivel de energía).
Para “l”=1, tenemos los tres orbitales de tipo “p”, uno dirigido según el eje y, otro según el eje z y el tercero según el eje x. Tienen simetría de revolución y se nombran px, py y pz, según los ejes sobre los que se orientan.
Para “l”=2, tenemos los cinco orbitales de tipo “d”, de formas complicadas y dirigido según varios ejes. La parte que se proyecta sobre cada eje tiene simetría de revolución y se nombran , según los ejes sobre los que se orientan.
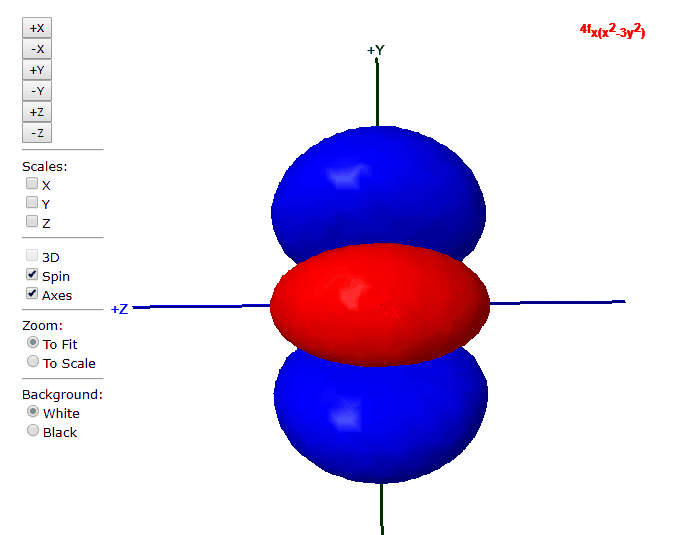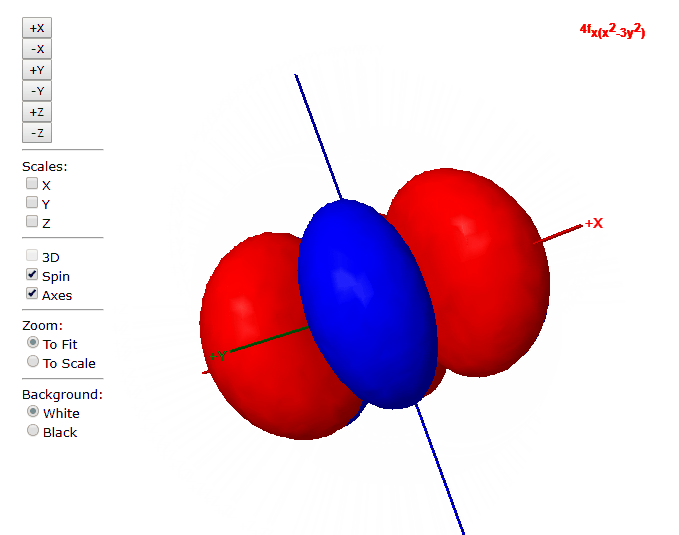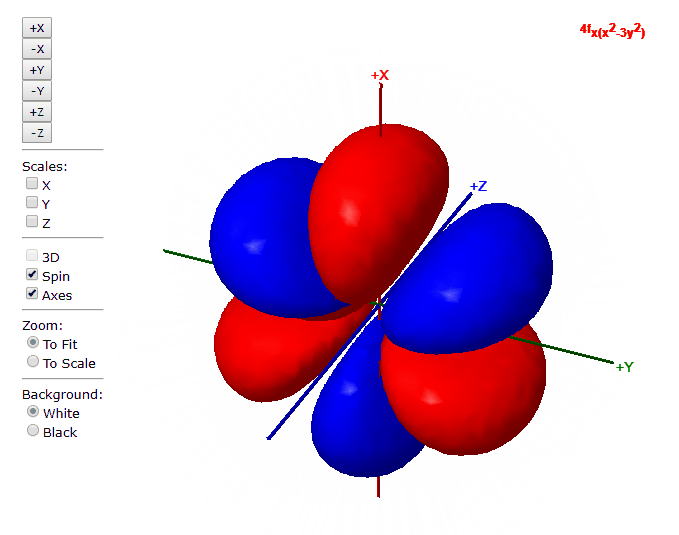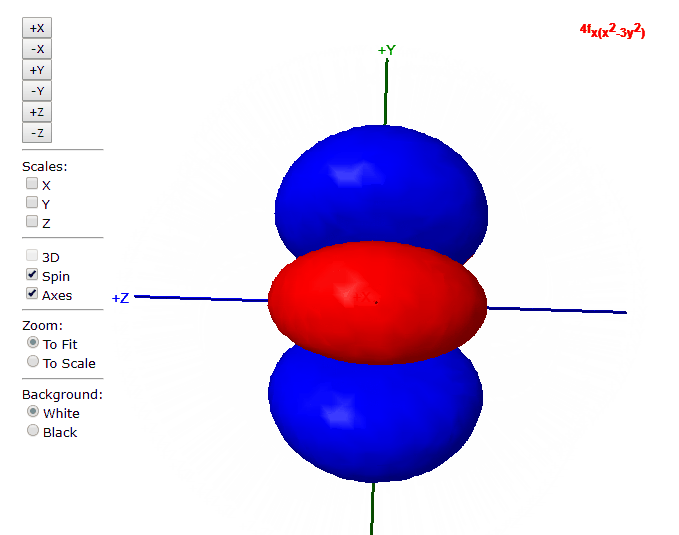
Para “l”=3, tenemos los siete orbitales de tipo “f”, con formas más complicadas que podremos ver en el applet de debajo
-
Distribución de los orbitales
De los valores permitidos de los números cuánticos, pueden sacarse las siguientes conclusiones:
1. Hay orbitales s en todas las capas. Los orbitales p aparecen a partir de la segunda capa; los d a partir de la tercera, y los f a partir de la cuarta.
2. Solo existe un orbital s en cada capa. Los orbitales p aparecen en grupos de tres; los d en grupos de cinco, y los f en grupos de siete.
3. En cada capa o nivel de energía hay n2 orbitales.
|
Capa |
n |
l |
m |
Número de orbitales |
Tipo de orbital |
Total |
|---|---|---|---|---|---|---|
|
Primera |
1 |
0 |
0 |
1 |
s |
1 = 12 |
|
Segunda |
2 |
0 1 |
0 -1, 0, 1 |
1 3 |
s p |
4 = 22 |
|
Tercera |
3 |
0 1 2 |
0 -1, 0, 1 -2, -1, 0, 1, 2 |
1 3 5 |
S p d |
9 = 32 |
|
Cuarta |
4 |
0 1 2 3 |
0 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
1 3 5 7 |
S p d f |
16 = 42 |
Applet para visualizar orbitales atómicos
En este applet podemos apreciar los orbitales atómicos del átomo de hidrógeno.
En estos enlaces tenemos applets similares:
TU GrazGraz University of Technology
En este otro applet podemos apreciar los orbitales atómicos del átomo de hidrógeno. ¡OJO no funciona en Chrome!
Actividad 1
Da un listado de los valores de n, l y m, para los orbitales de la subcapa 5f.
Actividad 2
¿Cuál es el número total de orbitales asociados al número cuántico principal n = 5? ¿Qué subcapas o subniveles hay en ese nivel?
Estructura electrónica de los átomos.
Cada electrón, en un átomo, queda identificado por cuatro números cuánticos, que suelen abreviarse como (n, l, m, s). De esta manera el electrón (2, 0, 0,+½) será un electrón situado en el orbital definido por los números cuánticos n=2, l=0 y m=0; además tendrá un spin s=+½.
Si indicamos los valores de los números cuánticos de cada electrón del átomo, tendremos definida su estructura electrónica, pero normalmente se abrevian estos datos o se representan esquemáticamente.
Es frecuente indicar solamente cuántos electrones pertenecientes al átomo hay en cada capa y subcapa energética de este. Esta distribución ordenada se denomina configuración electrónica. Así la configuración electrónica del helio sería 1s2, donde 1 indica la capa o nivel (n=1), s indica el subnivel (l=0) y el superíndice indica el número de electrones en el subnivel (hay dos electrones en el subnivel 1s)
A veces se usan los diagramas de orbitales, que muestran hasta el espín del electrón:
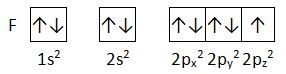
La flecha hacia arriba representa uno de los dos posibles spines del electrón, la flecha hacia abajo el otro. Cada caja representa un orbital atómico.
Hay una serie de reglas y consideraciones que nos permiten deducir las diferentes configuraciones electrónicas de los átomos con varios electrones:
-
Orden energético de los orbitales.
Los datos espectros atómicos nos revelan que los electrones de un átomo polielectrónico se reparten entre diversos niveles y subniveles energéticos.
En el átomo de hidrógeno, los orbitales de la misma capa tienen la misma energía. Por ejemplo, los orbitales 4s, 4p, 4d y 4f tienen igual energía. La energía de un orbital depende solo de n (nº cuántico principal).
En los átomos polielectrónicos, las repulsiones electrón-electrón hacen que la energía de los orbitales también dependa de l (nº cuántico secundario). Estas repulsiones explican también los solapamientos entre subniveles de distintas capas. Así todos los orbitales del mismo subnivel tienen la misma energía (orbitales degenerados), salvo cuando se somete al átomo a un campo magnético intenso (efecto Zeeman).
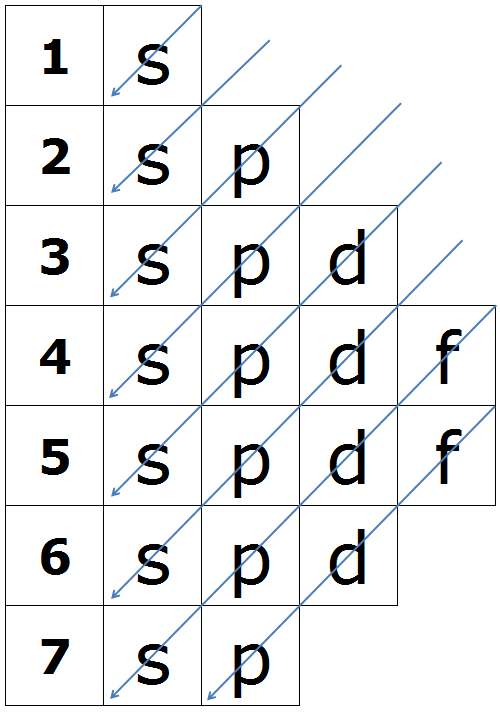
Los electrones entran en los distintos orbitales por estricto orden de energías. El orden de llenado (energías crecientes) viene dado por la regla cuántica n+l, que indica que los orbitales han de llenarse en orden creciente del valor de la suma n+l y en caso de que coincida el valor se ha de llenar antes el de menor valor de n. Este enunciado es equivalente a seguir el diagrama de Moeller.
-
Principio de exclusión de Pauli.
El principio de exclusión fue enunciado en 1925 por el físico austriaco Wolfgang Pauli, es útil para determinar las configuraciones electrónicas de los átomos polielectrónicos.
El principio de exclusión establece que no es posible que dos electrones de un mismo átomo tengan los cuatro valores de los números cuánticos iguales.
Como corolario se deduce que si dos electrones están en el mismo orbital atómico deben tener distintos valores del número cuántico de spin. En otras palabras, en el mismo orbital atómico sólo puede haber un máximo de dos electrones, que además deben tener espines opuestos.
-
Regla de máxima multiplicidad de Hund
Cuando varios electrones ocupan orbitales de la misma energía (los pertenecientes al mismo subnivel energético) se pueden dar varias disposiciones posibles. Debido a que dos electrones situados en un orbital, se repelen eléctricamente con más fuerza que si estuviesen en orbitales diferentes se cumple la regla de máxima multiplicidad de Hund, que dice:
Si en un mismo subnivel hay disponibles varios orbitales, los electrones se colocan de modo que ocupan el mayor número de ellos (desapareados), y además, con espines iguales o paralelos.
-
Principio de construcción (Aufbau)
La configuración electrónica de un átomo de un elemento químico (de número atómico Z), se puede construir a partir del anterior (número atómico Z-1), añadiendo un electrón (electrón diferenciador).
Para ello se van añadiendo electrones siguiendo el orden energético (9.1), respetando el principio de exclusión de Pauli (9.2) y verificando la regla de máxima multiplicidad de Hund.
Actividad 1
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: F (Z=9), Mg (Z=12), Cr (Z=24), Cu (Z=29)
Solución:
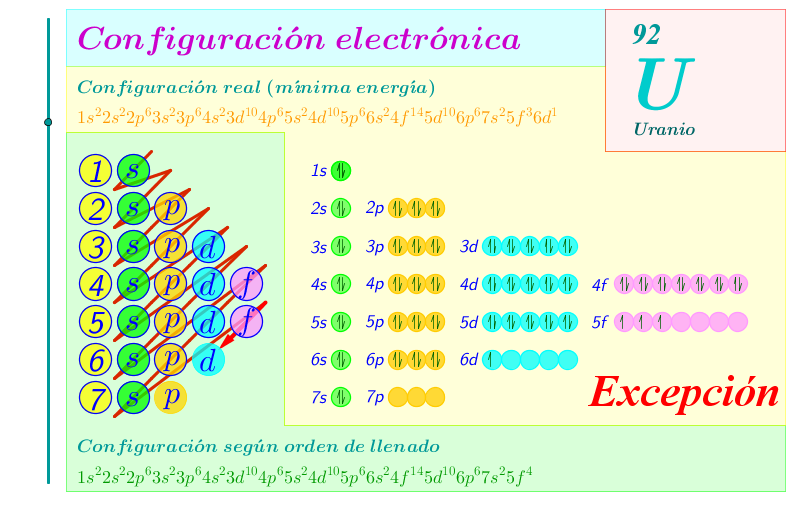
Actividad 2
Establece las configuraciones electrónicas correspondientes a los átomos en estado fundamental de: Ra (Z=88), U (Z=92), Au (Z=79), Po (Z=84)
Solución:
Applet Aufbau
Clasificación periódica de los elementos.
La tabla periódica actual, formada por 18 grupos o columnas (formados por elementos con propiedades químicas parecidas) y 7 periodos o filas (en los que cada elemento aumenta en una unidad el número atómico del elemento precedente).
Los períodos empiezan siempre (excepto el primero) con un metal alcalino (grupo 1) y terminan con un halógeno (grupo 17) seguido de un gas noble (grupo 18)
Los metales ocupan la parte izquierda y central de la tabla, y los no metales se sitúan a la derecha. Entre ambos están los semimetales (B, Si, Ge, As, Sb, Te, Po). La línea de separación es tan difusa que en diferentes textos pueden aparecer otros elementos como semimetales o metaloides.
El primer período sólo contiene 2 elementos; el segundo y el tercero 8 cada uno; el cuarto y el quinto están formados por 18 elementos cada uno; el sexto 32, y el séptimo aún está por completar.
Existen 18 familias o grupos:
- Elementos representativos, 8 grupos con nombres propios:
o Grupo 1 Alcalinos
o Grupo 2 Alcalinotérreos
o Grupo 13 Térreos o boroideos
o Grupo 14 Carbonoideos
o Grupo 15 Nitrogenoideos
o Grupo 16 Anfígenos
o Grupo 17 Halógenos
o Grupo 18 Gases nobles o inertes
- Elementos (metales) de transición, 10 grupos (del 3 al 12), en el centro del sistema periódico.
- Elementos (metales) de transición interna o tierras raras, se suelen colocar en dos filas de 14 elementos (algunas veces 15, si se incluyen el Lu y el Lw) debajo de la tabla principal (tabla corta, más fácil de manejar), aunque a veces se colocan entre los grupos 2 y 3 (tabla larga, conceptualmente más correcta). La I.U.P.A.C propone considerar que el La y el Ac forman parte de los lantánidos y los actínidos, respectivamente, el Lu y el Lw serían elementos de transición.
-
Justificación de la tabla periódica.
Si calculamos las configuraciones electrónicas de los distintos elementos químicos encontramos unas regularidades que nos explican mejor aún la distribución de los elementos en la tabla periódica. Estas regularidades se relacionan con la configuración de las últimas capas electrónicas:
- Elementos representativos, tienen el electrón diferenciador en una subcapa de tipo “s” o “p”:
o Grupo 1 Alcalinos ns1
o Grupo 2 Alcalinotérreos ns1
o Grupo 13 Térreos o boroideos ns2p1
o Grupo 14 Carbonoideos ns2p2
o Grupo 15 Nitrogenoideos ns2p3
o Grupo 16 Anfígenos ns2p4
o Grupo 17 Halógenos ns2p5
o Grupo 18 Gases nobles o inertes ns2p6
- Elementos (metales) de transición, tienen el electrón diferenciador en una subcapa de tipo “d”.La configuración de las últimas capas viene dada por ns2(n-1)dx, donde x es un número del 1 al 10 que representa el orden de la columna entre los elementos de transición.
- Elementos (metales) de transición interna o tierras raras, tienen el electrón diferenciador en una subcapa de tipo “f”.La configuración de las últimas capas viene dada por ns2(n-2)fx,donde x es un número del 1 al 14 que representa el orden de la columna entre los elementos de transición interna.
Dada la proximidad energética de los distintos subniveles, es frecuente encontrar excepciones a estas regularidades entre los elementos de transición y de transición interna. Esto se debe a que algunas configuraciones hacen que la energía conjunta del átomo disminuya, entre ellas:
o Último orbital lleno.
o Orbitales internos llenos.
o Orbitales semillenos.
o Último orbital semilleno.
Hay que señalar que al ocupar como el electrón diferenciador el antepenúltimo nivel, todos los elementos de transición interna, al tener comunes las configuraciones electrónicas de las dos últimas capas de energía, tienen propiedades casi idénticas.
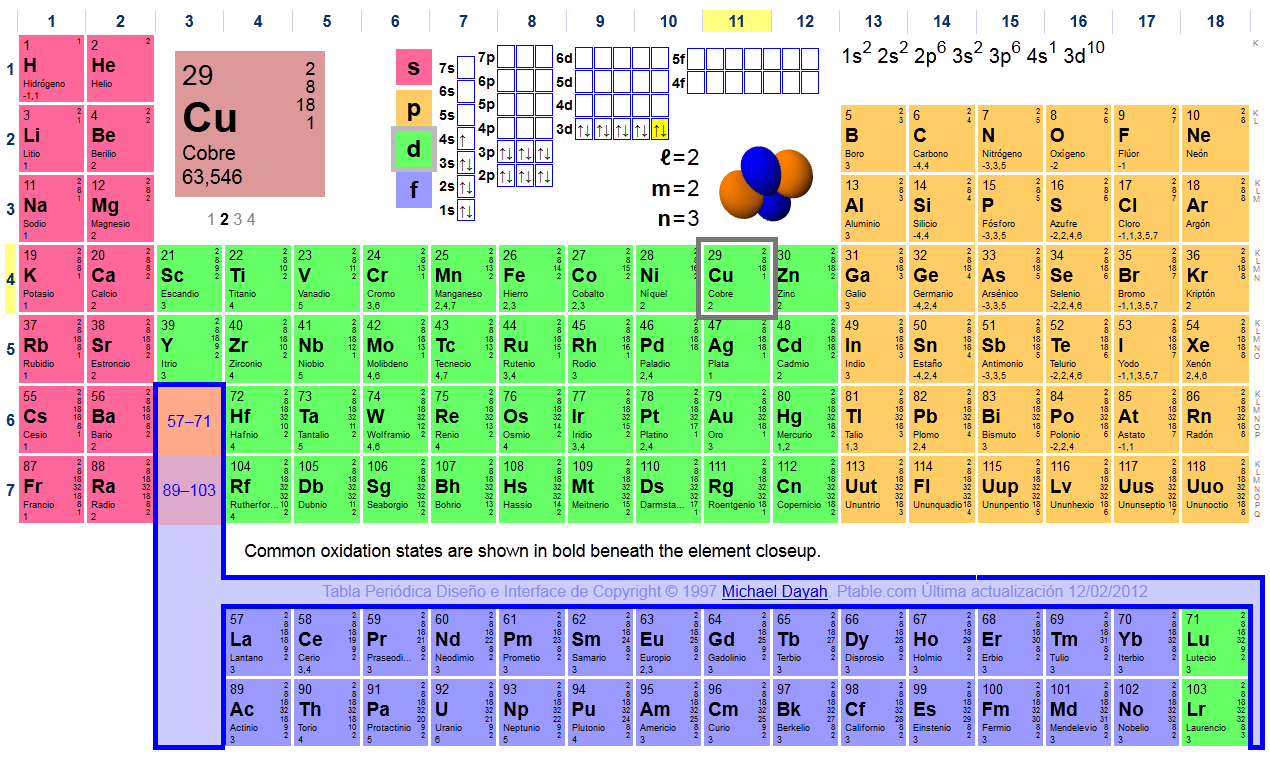
Applet tabla periódica
Aquí tenéis una de las tablas periódicas más completas de la red.
Actividad 1
Dados los siguientes elementos químicos: oxígeno (O, Z = 8), calcio (K, Z = 19), hierro (Fe, Z = 26) y radón (Rn, Z = 86), sitúalos en el sistema periódico.
Actividad 2
Con la ayuda de una tabla periódica en blanco indica, para cada uno de los elementos que corresponden a los números atómicos que se proporcionan su símbolo y su nombre, así como la configuración electrónica de las últimas capas y la familia a la que pertenecen: a) Z = 54; b) Z = 34; c) Z = 51; d) Z = 15; e) Z = 17; f) Z = 36.
Tabla periódica. Elementos con números de oxidación.
Los elementos que aparecen remarcados en esta tabla periódica son los que debéis estudiar (como mínimo). Os puedo preguntar: nombre, símbolo y números de oxidación.