1. Introducción
Las sustancias químicas están formadas por agrupaciones de átomos; incluso las últimas partículas de las sustancias simples como el hidrógeno (H2) o el oxígeno (O2) están formadas por la unión de varios átomos, solo los gases nobles están en la naturaleza como átomos aislados. El enlace químico es el responsable de la unión estable entre dos o más átomos.
Todos los sistemas físicos tienden a alcanzar el estado de mínima energía, los átomos se unen con la misma finalidad, formar sustancias con menor energía que la que tendrían los átomos por separado. En este proceso intervienen fuerzas de origen electrostático, tanto de atracción como de repulsión, que ocasionan que los electrones de las capas más externas de los átomos se redistribuyan en sus nuevas localizaciones.
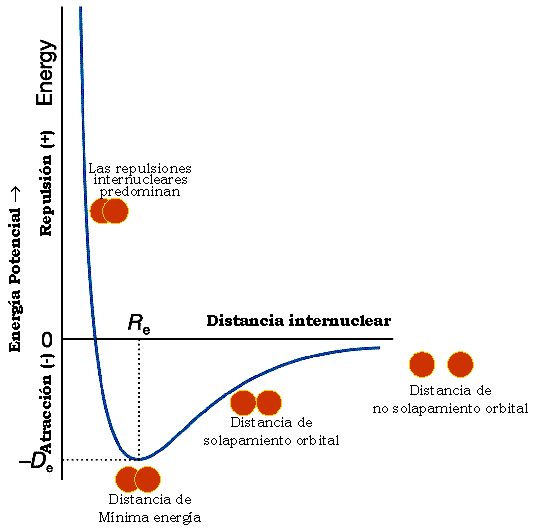
Aquí vemos la curva de estabilidad energética que muestra la variación de energía que experimenta un sistema formado por dos átomos en función de la distancia que los separa. En ella se observa que para la distancia internuclear (Re), denominada distancia de enlace o radio de enlace el sistema es más estable, pues predominan las fuerzas atractivas sobre las repulsivas.
El valor de la energía potencial a esa distancia es un mínimo y se corresponde con la energía de enlace (De), que es la energía que se desprende en la formación de dicho enlace. Cuanto más profundo es el pozo de la gráfica, mayor es la estabilidad de la molécula.
En esta animación se aprecia mejor como funciona el pozo de potencial.
Toda teoría sobre el enlace químico deberá ser capaz de explicar:
1. Los diferentes tipos de enlace que pueden darse entre los átomos.
2. La disposición en el espacio (geometría) que adoptan los átomos enlazados.
3. Las propiedades de una sustancia en función del enlace.
De la configuración electrónica de la capa más externa, depende el tipo de enlace que forman los átomos. Los electrones que se sitúan en esa capa se conocen como electrones de valencia. Lewis toma como modelo de estabilidad a los gases nobles que presentan una distribución electrónica con los orbitales s y p del último nivel llenos (ns2 np6). Los otros elementos tienen esos orbitales incompletos, por eso son más reactivos. Kossel y Lewis (1916) establecen que cuando se unen dos elementos representativos, ambos intentan alcanzar la configuración de gas noble, bien tomando o cediendo electrones (enlace iónico, Kossel), bien compartiendo uno o varios pares de electrones (enlace covalente, Lewis). Esta observación se conoce como regla del octeto:
Los átomos tienden a captar, a ceder o a compartir electrones hasta quedar rodeados de ocho electrones de valencia.
Para destacar los electrones de valencia, usa diagramas de puntos de Lewis, en los que se dibujan rodeando el símbolo del elemento tantos puntos como electrones posea en la última capa. Aquí vemos los diagramas de puntos de los elementos del segundo periodo:
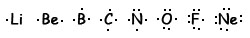
La regla del octeto, aunque muy útil, tiene muchas excepciones, como vamos a ver.
- Octeto expandido. A partir del tercer del tercer período, algunos elementos (al tener orbitales d), pueden rodearse de más de ocho electrones; por ejemplo, en el PCl5 el fósforo está unido con cinco átomos de cloro, así que tendrá diez electrones a su alrededor.
- Octeto incompleto. Otros elementos se estabilizan con menos de ocho electrones a su alrededor; por ejemplo, el BF3 en el que el boro está rodeado por seis electrones.
- El hidrógeno, el litio, el berilio son estables con solo dos electrones en su capa 1s.
- Los elementos de transición, al tener orbitales d incompletos, tienen difícil seguir la regla del octeto. Deberían perder o ganar demasiados electrones. Para ellos, una configuración bastante estable se alcanza cuando los orbitales d están semillenos con cinco electrones.
En cualquier caso la formación espontánea de un enlace manifiesta la tendencia de cada átomo a alcanzar la configuración electrónica más estable posible, la de menor energía.
EJEMPLO 1
Tenemos tres elementos cuyo nivel de valencia es: a) ns1; b) ns2p4; c) ns2p6. Explicar su tendencia a ganar o perder electrones. Indica razonadamente él tipo de enlace que formarán.
2. Enlace iónico
2.1. Estructura del enlace iónico
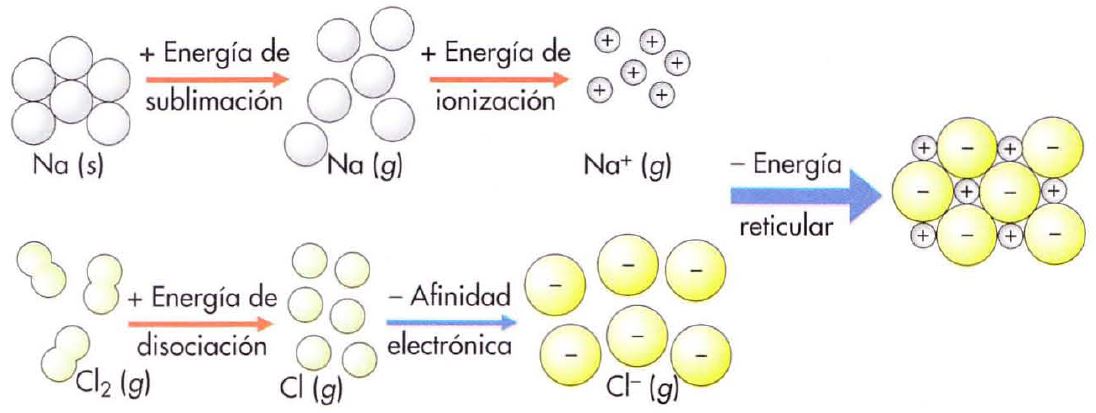
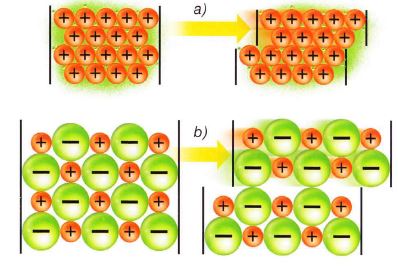
Cuando se unen un elemento muy electropositivo con otro muy electronegativo se forma entre ellos un enlace iónico. Este consiste en una transferencia de uno o varios electrones del átomo del elemento metálico al no metálico, formándose dos iones que se unen por atracción electrostática.
Podemos representar la reacción mediante un diagrama de puntos:
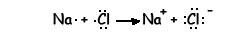
El sodio y el cloro han conseguido alcanzar la estructura electrónica de gas noble.
|
Na 1s2 2s2 2p6 3s1 |
Cl 1s2 2s2 2p6 3s2 3p5 |
|
Na+ 1s2 2s2 2p6 |
Cl- 1s2 2s2 2p6 3s2 3p6 |
|
Na (g) → Na+ (g) + e- ΔEI= 495,0 kJ/mol (Energía de ionización) Cl (g) + e- → Cl- (g) ΔEA= -349,5 kJ/mol (Electroafinidad) |
|
Na (g) + Cl (g) → NaCl (g) ΔET= 145,5 kJ/mol (Balance energético) |
Como podemos observar, hay que invertir más energía en extraer el electrón del sodio, que la que desprende el cloro al adquirir un electrón. Es decir en el proceso aumenta la energía en lugar de disminuir.
Para estabilizar el compuesto debemos formar una red cristalina por atracción electrostática entre los iones. En la formación del cristal se libera la energía reticular, que en nuestro caso sería:
|
Na (g) → Na+ (g) + e- ΔEI= 495,0 kJ/mol (Energía de ionización) Cl (g) + e- → Cl- (g) ΔEA= -349,5 kJ/mol (Electroafinidad) Na+ (g) + Cl- (g) → NaCl (cristal) ΔEC= -765,0 kJ/mol (Energía reticular) |
|
Na (g) + Cl (g) → NaCl (cristal) ΔET= -619,5 kJ/mol (Balance energético) |
Con lo que sumando nos queda que en el proceso total disminuye la energía, obteniendo así un sistema más estable.
Por lo tanto la fórmula NaCl indica solamente que hay el mismo número de iones Na+ y Cl-, ya que la estructura estable es una estructura cristalina formada por infinidad de átomos, es decir, la fórmula de un compuesto iónico es siempre una fórmula empírica.
2.2. Redes cristalinas
El cristal del que hablamos antes está formado por iones de signo opuesto unidos entre si por fuerzas electrostáticas que hacen que cada uno se rodee de iones de carga opuesta. En condiciones ordinarias los compuestos iónicos son sólidos, los iones positivos (Na+) y negativos (Cl-) están prácticamente en contacto y se hallan dispuestos en posiciones fijas formando una estructura ordenada que se extiende indefinidamente en el espacio, formando retículos cristalinos o redes espaciales.
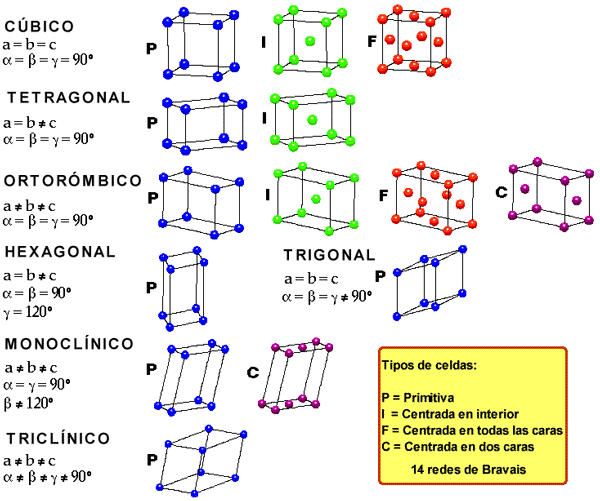
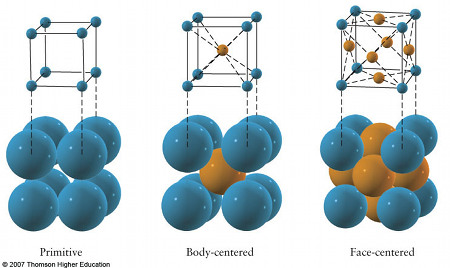
Hay siete sistemas cristalográficos en función del tipo de poliedro en el que pueden colocarse los iones. Según si estos ocupan los vértices, los centros de las caras o el centro del cuerpo de dichos poliedros se desdoblan en catorce disposiciones conocidas como redes de Bravais. El más sencillo de los poliedros que se pueden formar con un retículo cristalino recibe el nombre de celdilla unidad.
El número de iones que rodea a cada ion de signo contrario se llama índice de coordinación de este. El tipo de red y el índice de coordinación depende del tamaño relativo de los iones (por impedimento estérico) y de la carga de estos.
En el caso del NaCl (halita), el radio del Cl- es casi el doble que el del Na+. Alrededor del Cl- se podrían colocar hasta 12 iones Na+, pero alrededor del Na+ solo se pueden situar seis iones Cl-. El I.C. del Na+ será 6, además como ambos tienen la misma carga (en valor absoluto) el I.C. del Cl- también debe ser 6 para mantener el cristal sin exceso o defecto de carga. De esto resulta una red en la que cada ion ocupa el centro de un octaedro regular, en cuyos vértices se sitúan iones de signo contrario. Esta propiedad geométrica la cumple una red cúbica centrada en las caras.
En el caso del CsCl, como el ion Cs+ es mayor que el ion Na+, alrededor del Cs+ pueden situarse ocho iones Cl-, alrededor del Cl- podrían situarse más iones Cs+ , pero como tienen la misma carga ambos deben tener l.C.= 8, con lo que resulta una red en la que cada ion ocupa el centro de un cubo en cuyos vértices se sitúan iones de signo contrario. Esta propiedad geométrica la cumple red cúbica centrada en el cuerpo.
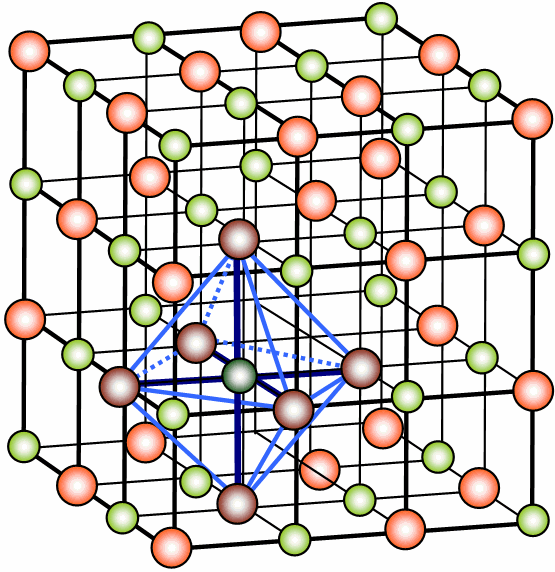
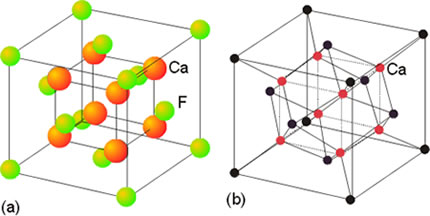
En el fluoruro de calcio (fluorita) CaF2 debe haber el doble de iones F- que de iones Ca2+. El índice de coordinación de Ca2+ y de F- ya no va a ser el mismo. El del Ca2+ debe ser el doble que el del F-. En este caso el l.C. del Ca2+ es 8 y el l.C. del F- es 4. Esta propiedad geométrica la cumple red cúbica centrada en las caras para el Ca2+ y tetraédrica para el F–
Enlaces a representaciones 3D de la estructura cristalina de:
Para calcular el nº de átomos por celda se toma una celda unidad y:
· Se divide por 8 el nº de iones de los vértices.
· Se divide por 4 el nº de iones de las aristas.
· Se divide por 2 el nº de iones centrales de las caras.
· Se suman todos y se añaden los iones del interior de la celda.
EJEMPLO 1
Calcular el nº de cationes y aniones que hay en las celdas de NaCl, CsCl y CaF2
2.3. Energía reticular
Cuando hemos realizado el balance energético del proceso de formación del enlace iónico nos hemos referido a la energía reticular U, que vamos a analizar a continuación más detenidamente.
La energía reticular de una sustancia Er se define como la energía necesaria para descomponer un mol de sustancia en estado cristalino en sus iones componentes en estado gaseoso. Por lo tanto un cristal iónico será más estable cuanto mayor sea su energía reticular.
El cálculo de esa energía reticular se puede hacer con la siguiente expresión:
donde K es la constante de Coulomb en el vacío (9·109 N·m2/C2), Z+ y Z- son las cargas de los iones, e el valor absoluto de la carga del electrón, Na el número de Avogadro, do la distancia internuclear, A es la constante de Madelung que depende del tipo de red cristalina, y n es el factor de compresibilidad del cristal o coeficiente de Born.
Se observa que la energía reticular aumenta al aumentar la carga de los iones y al disminuir el radio de los mismos.
Cuanto mayor sea la energía reticular, el cristal tendrá un punto de fusión más elevado, será más duro y en general será más estable
EJEMPLO 1
Calcular la energía reticular de la fluorita (CaF2), sabiendo que la distancia de equilibrio entre iones en el cristal es de 250 pm y conociendo los siguientes datos: Constante de Madelung : A = 2,519 ; Constante de Coulomb para el vacío : k = 9·109 N·m2/C2 ; Carga del electrón : e = 1,60·10-19 C ; Coeficiente de Born : n = 8
Solución: Aplicando la fórmula se obtiene 2447 kJ/mol
EJEMPLO 2
Ordena de mayor a menor energía reticular, sin tener en cuenta la constante de Madelung ni el factor de compresibilidad, los siguientes compuestos: MgS; LiBr; LiCl; MgO.
Solución.
La energía reticular en valor absoluto aumenta con la carga de los iones y disminuye con la distancia internuclear, si no tenemos en cuenta la influencia de la constante de Madelung ni el factor de compresibilidad.
En este caso, el producto Z+ Z- valdrá 4 para el MgS y para el MgO, mientras que para el LiBr y el LiCl solo valdrá 1. Es decir, teniendo solo este factor en cuenta, se cuadruplica el valor de U para MgS y MgO, respecto de LiBr y LiCl. El valor de la distancia internuclear será la suma de los radios iónicos. Entre MgS y MgO será mayor para el primero, pues en el mismo grupo el radio aumenta a medida que descendemos en él, y entre LiBr y LiCl también será mayor do para el primero por idéntico motivo.
En todo caso, las distancias internucleares de ambas parejas nunca tendrán valores tan diferentes como para superar el factor 4 debido a la carga de la primera, por lo que la ordenación creciente de energía reticular en valores absolutos será: LiBr < LiCl < MgS < MgO
2.4. Ciclo de Born-Haber
El cálculo de la energía reticular usando el método anterior suele resultar impreciso. Por ello se recurre a un método basado en la ley de Hess (que estudiaremos más adelante), conocido como ciclo de Born-Haber
Suponemos que el cambio energético en la formación de un sólido iónico en relación con los elementos en su estado normal se puede calcular como una reacción química directa (si la formación del sólido supone una disminución de energía, el compuesto será más estable que los elementos), o en varios procesos parciales cuya suma será la reacción global.
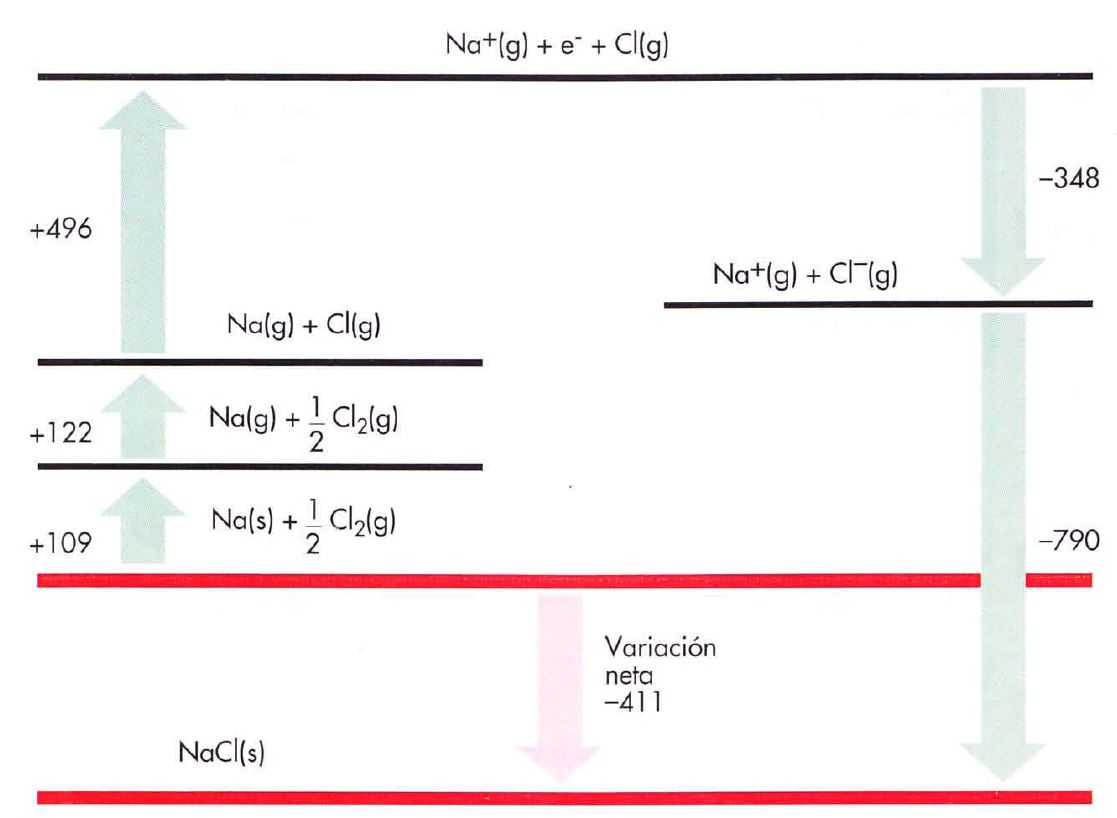
Vamos a estudiar el caso concreto del NaCl, imaginando que la reacción de formación:
|
Reacción química directa Na (s) + ½Cl2 (g) → NaCl (s) Qreacción |
|
|
|
Tiene lugar a través de una serie de procesos parciales: Para que se formen los iones Na+ y Cl-, el metal habrá de separar sus átomos entre sí (sublimación), y luego cada átomo deberá perder un electrón (ionización); el no-metal, tendrá, primero, que romper la molécula (disociación) y, a continuación, cada átomo deberá perder un electrón (afinidad electrónica). Por fin los iones Na+ y CI-, se unen para formar la red cristalina. En este proceso se liberará una energía exactamente igual a la energía reticular. |
|
Procesos parciales
Na (s) + Es → Na (g) Esublimación 109 kJ/mol Na (g) + Ei → Na+ (g) + e- Eionización 496 kJ/mol ½Cl2 (g) + ½Ed→ Cl (g) ½Edisociación 122 kJ/mol Cl (g) + e- → Cl- (g) + Eaf Eafinidad -348 kJ/mol Na+ (g) + Cl- (g) → NaCl (s) + U U -790 kJ/mol |
|
La reacción global se obtiene sumando las anteriores, quedando: Na (s) + ½Cl2 (g) → NaCl (s) Qreacción -411 kJ/mol Donde el cálculo de energías sería como sigue: Esublimación + Eionización + ½ Edisociación + Eafinidad + U = Qreacción |
|
|
EJEMPLO 1
Indica cómo aplicarías el ciclo de Born-Haber para el cálculo de la energía reticular del fluoruro de calcio.
Qreacción =-1220 kJ/mol ; Esublimación Ca = 179 kJ/mol ; 1ª Eionización Ca = 590 kJ/mol
2ª Eionización Ca =1145 kJ/mol ; Edisociación F2 = 139 kJ/mol ; Eafinidad F = -328 kJ/mol
Solución: U= -2617 kJ/mol
2.5. Propiedades de los compuestos iónicos
Los cristales iónicos tienen están formados por aniones y cationes que se unen debido a las fuerzas de electrostáticas, estos iones suelen ser de distinto tamaño y pueden tener distintas cargas, lo que da como resultado distintas estructuras reticulares.
Las fuerzas de atracción entre iones de signo opuesto son muy fuertes y se necesita mucha energía para romper la red cristalina. Esta ruptura se puede producir debido a un proceso de fusión, lo que requiere elevadas temperaturas o por un proceso de disolución, para lo que se necesitan disolventes polares, como el agua. Las moléculas polares rodean a los iones de la red, consiguiendo separarlos de esta, posteriormente las moléculas del disolvente rodean al ion ya separado del cristal (solvatación).
Las fuerzas de atracción siguen la ley de Coulomb, es decir, son directamente proporcionales al producto de las cargas e inversamente proporcionales al cuadrado de las distancias entre iones. Por eso los compuestos que funden a mayor temperatura y los que se disuelven peor, incluso en disolventes polares, son los que contienen iones con mayor carga.
En cuanto a sus propiedades mecánicas, los sólidos iónicos son duros pero frágiles. La dureza es la resistencia que tiene un material a ser rayado, los sólidos iónicos son duros ya que para rayarlos hay que romper enlaces muy fuertes. La fragilidad se debe a que al sufrir un impacto, en el cristal, se produce una aproximación entre iones del mismo signo, lo que -debido a las fuerzas de repulsión entre iones del mismo signo- provoca la ruptura del cristal.
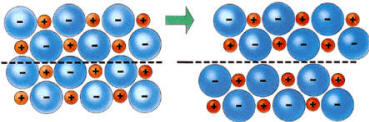
Los compuestos iónicos no son conductores de la electricidad en estado sólido, puesto que los electrones están firmemente sujetos por los iones, los cuales permanecen fijos en la red. En cambio, fundidos se convierten en conductores, siendo los mismos iones los que se mueven conduciendo la corriente eléctrica.
Disueltos en agua también conducen la corriente eléctrica, debido a la movilidad que adquieren sus iones. Las sustancias que se comportan así se llaman electrólitos.
3. Enlace covalente.
Se produce entre átomos electronegativos. La mayoría de las sustancias que nos rodean (plástico, madera, agua, oxígeno, glucosa) tienen sus átomos unidos por este tipo de enlace.
En 1916 Lewis propuso la regla del octeto que comentamos en la introducción del tema. A continuación indicó que cuando dos átomos no metálicos entran en contacto, pueden formar un enlace compartiendo un par de electrones, para así completar el octeto, alcanzando la estructura de gas noble.
Un enlace covalente consiste en la compartición de uno o más pares de electrones entre dos átomos, cumpliendo la regla del octeto. Estos electrones compartidos se sitúan entre los átomos, ejerciendo su atracción sobre ellos y manteniéndolos así unidos.
Como ocurría en el enlace iónico, la energía del sistema disminuye respecto de la que tenían los átomos por separado, obteniendo así una estructura más estable.
3.1. Teoría del enlace de valencia (TEV). Estructuras de Lewis.
3.1.1 Teoría del enlace de valencia (TEV).
Uno de los primeros intentos de explicar la formación de enlaces covalentes mediante la mecánica cuántica es la teoría del enlace de valencia (TEV). Fue desarrollada en 1927 por Heitler y London.
Supone que los orbitales atómicos se solapan (se acercan y superponen). Para ello los orbitales enlazados han de cumplir ciertas condiciones de simetría, de manera que la superposición de orbitales sea máxima. Eso supone una mayor estabilidad y un menor contenido de energía. La superposición de los dos orbitales atómicos lleva consigo el apareamiento de los spines electrónicos. Así aumenta la densidad de carga electrónica entre los núcleos, es decir se forma el enlace covalente.
Si existen orbitales vacíos en la misma capa, los electrones de valencia que estaban apareados inicialmente pueden desaparearse para intervenir en el enlace. Así se explican las valencias no esperadas de algunos elementos. El pequeño aumento de energía del paso de esos electrones a niveles ligeramente más energéticos se compensa con la disminución energética producida al formarse más enlaces.
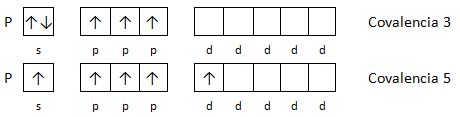
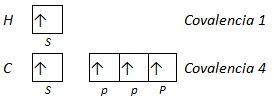
Aparece así el concepto de covalencia de un elemento, que está relacionado con el número de electrones desapareados y representa el número de enlaces covalentes que se pueden formar.
Ejemplo 1: Indica las covalencias del fósforo.
El fósforo tiene la siguiente configuración electrónica: 1s2 2s2 2p6 3s2 3p3 , en la capa 3 hay orbitales d vacíos, con energías cercanas a la del subnivel 3p.
Si los orbitales que se solapan son los más sencillos, tipos s y p, se pueden considerar dos tipos de enlaces:
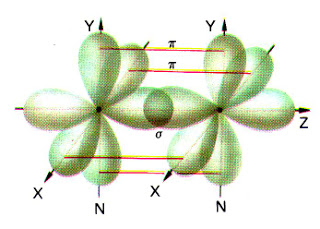
- Enlace σ. En el la región de densidad electrónica máxima rodea el eje internuclear. Se forma por solapamiento frontal de orbitales s y/o de orbitales p consigo mismos o entre ellos.
- Enlace π. En este caso, el área de superposición no rodea completamente el eje internuclear. Existen dos regiones separadas, de densidad electrónica elevada, a cada lado del eje. Se forma por solapamiento lateral de los orbitales p.
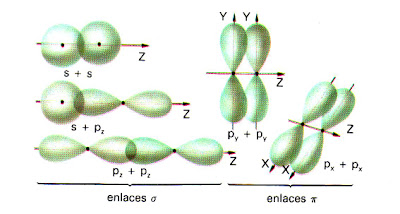
El enlace σ es más fuerte que el π ya que el solapamiento es mayor.
Veamos ahora algunos ejemplos de formación de enlaces mediante esta teoría:
|
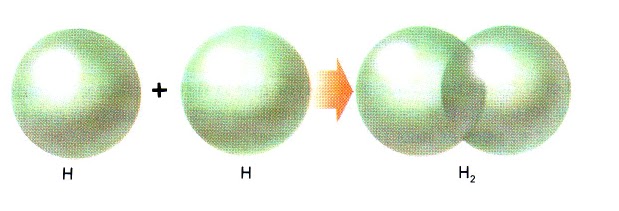
a) Molécula H2 |
|
|
|
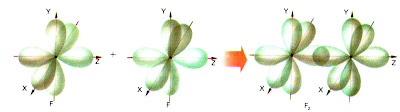
b) Molécula Cl2 |
|
|
|
|
3.1.2 Representación de estructuras de Lewis.
Para destacar los electrones de valencia, compartidos o no, se usan diagramas o estructuras de Lewis, en ellas cada átomo se indica con su símbolo rodeado de unos puntos que representan los electrones de valencia. Estos pueden aparecer también como cruces (para diferenciarlos de los del otro átomo) o como rayas (una raya representa un par de electrones)
Aunque para muchas moléculas e iones se pueden escribir sus estructuras de Lewis fácilmente, conviene seguir el siguiente procedimiento:
1º Contar el número total de electrones de valencia de los átomos, teniendo en cuenta la carga de la especie química, calculando el número de pares de electrones:
SO42- |
Átomo |
Número |
e- de valencia |
Total |
|
S |
1 |
6 |
6 |
|
|
O |
4 |
6 |
24 |
|
|
carga |
2 |
1 |
2 |
|
|
|
32 e- |
|||
|
32/2 = 16 pares |
||||
2º Distribuir los átomos en torno al átomo central (en general el menos electronegativo), añadir un par de electrones entre cada átomo y los ligandos (los átomos que se unen al central) y colocar pares de electrones en los ligandos hasta cumplir la regla del octeto (en el hidrógeno sólo un par de e-). Si sobran pares de electrones se colocan en el átomo central (octeto ampliado).
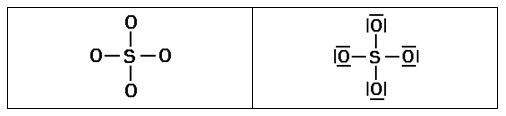
3º Evaluar las cargas formales de cada átomo y etiquetarlos (si la carga formal es cero no se suele etiquetar). La carga formal es la diferencia entre los e- de valencia del átomo aislado y el nº de e- asignado a ese átomo en la estructura de Lewis. En general, CF = V – 2·PP – PC, donde CF=carga formal del átomo, PP pares de electrones propios (no compartidos), PC pares de electrones compartidos.
En general si la carga formal del átomo central es igual a cero, la estructura es correcta. Se pueden reducir las cargas formales por formación de enlaces múltiples (hasta la máxima covalencia del elemento central) mediante la ampliación del octeto del átomo central (si dispone de orbitales “d” vacíos, elementos del tercer período y siguientes), compartiendo pares de electrones con los ligandos con CF negativa.
- En una molécula neutra la suma de las CF será 0.
- En una especie iónica la suma de las CF será igual a la carga del ión.
- Las CF deben ser tan pequeñas como sea posible.
- Las CF negativas deben estar sobre los elementos más electronegativos a ser posible.
- Estructuras de Lewis con CF del mismo signo sobre átomos adyacentes son poco probables.

(En la página http://treefrog.fullerton.edu/chem/at.html podéis encontrar múltiples tutoriales animados para la construcción de estructuras de Lewis y más. -El enlace no funciona desde hace algún tiempo-, avisaré si hay novedades)
Aquí tenéis una página interactiva con algunos ejemplos: http://www.stolaf.edu/depts/chemistry/courses/toolkits/121/js/lewis/
Intentad construir las estructuras de Lewis de las siguientes sustancias:
1)
2)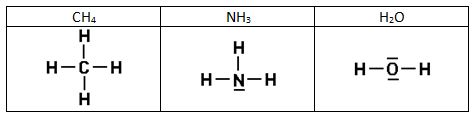
3)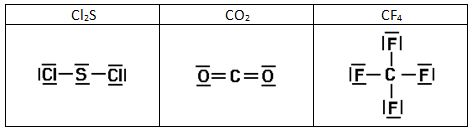
4)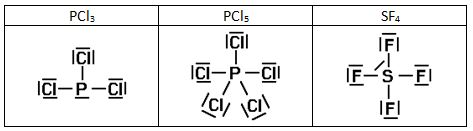
5)
6) En algunos casos tenemos el octeto incompleto, por ejemplo en los siguientes compuestos:
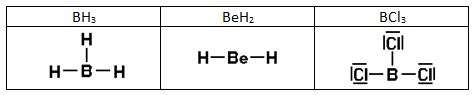
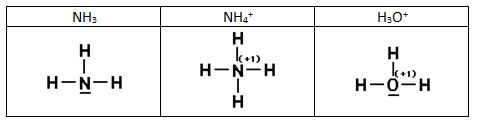
Enlace covalente dativo o coordinado.
Los electrones que forman el enlace covalente no siempre proceden de cada uno de los átomos que participan en el enlace, puede que los dos electrones sean aportados por uno sólo de los átomos. Así el ión amonio se forma mediante la combinación de un ion H+ con una molécula de amoniaco que tiene un par de electrones no compartido, que ahora va a compartir con el H+. En estos casos, donde el par de electrones lo aporta sólo uno de los átomos que se enlazan mediante un enlace covalente, se dice que se ha formado un enlace covalente dativo o coordinado, que se solía representar mediante una flecha que va del átomo dador al receptor. Sin embargo el estudio experimental de los enlaces indica que los cuatro enlaces covalentes son equivalentes y no conviene distinguir unos de otros basta indicar que la CF del N será ahora +1. El ión hidronio se forma de manera análoga.
En el ozono hay dos estructuras que satisfacen la regla del octeto para el átomo central. Pero ninguna de estas estructuras explica que las longitudes de enlace medidas experimentalmente sean iguales. En principio esperaríamos que el enlace O - O en el enlace O = O ya que los enlaces dobles son más fuertes que los sencillos.
Para resolver esta discrepancia se escriben ambas estructuras de Lewis para representar la molécula de ozono, indicando mediante una doble flecha que son estructuras resonantes (aunque no resuenan –alternan entre ellas- ya que ninguna de ellas existe realmente), o bien la estructura de la segunda celda (híbrido de resonancia)
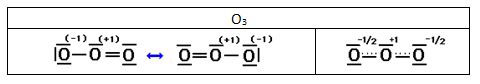
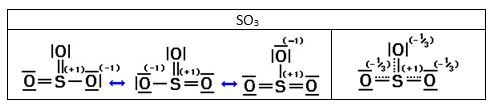
Las estructuras de Lewis representan a los electrones o entre dos átomos en un enlace covalente o en un átomo como electrones no compartidos. Pero los electrones se pueden repartir entre varios átomos si esa es la configuración más estable. En el ozono, un par de electrones de uno de los oxígenos y los electrones del doble enlace, se reparten (deslocalizan) en los tres átomos de la molécula. La superposición de las dos estructuras de Lewis se representan a veces usando una línea discontinua que indica un enlace “parcial”. En el caso del ozono, el enlace punteado estaría repartiendo 4 electrones, pero de estos solo uno estaría asociado al átomo central y uno y medio a cada uno de los oxígenos de los extremos, que llevarían cada uno media carga negativa.
Otro posible ejemplo de resonancia es la molécula de S03 de la que se sabe que es una molécula plana que posee los tres enlaces azufre-oxígeno idénticos de longitud intermedia entre la longitud correspondiente a un enlace sencillo S - O y la longitud de uno doble S = O.
Uno de los ejemplos más conocidos es la molécula de benceno (C6H6)
Moléculas con número impar de electrones.
Algunas moléculas contienen un número impar de electrones. Entre ellas se encuentra el monóxido de nitrógeno NO y el dióxido de nitrógeno NO2. Al ser impar el número de electrones no puede cumplirse la regla del octeto para todos los átomos. Estas moléculas se comportan como radicales y suelen ser muy reactivas, ya que el electrón desapareado intenta formar un enlace covalente con un electrón desapareado de otra molécula.
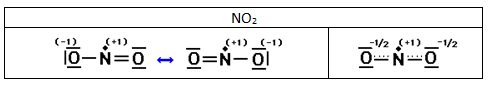
Ejemplo 1
Indica las estructuras de Lewis de las siguientes moléculas: H2S, HClO, CCl4, SF6, HCN, HClO2, HClO3, HClO4
3.2. Geometría molecular. Modelo RPECV (VSEPR en inglés)
Las estructuras de Lewis no indican nada acerca de la geometría de las moléculas. La molécula de H2 es lineal, la de H20 angular la de NH3 piramidal. Las longitudes de los enlaces así como los ángulos que forman entre sí se determinan experimentalmente mediante diversos métodos (análisis de propiedades químicas, difracción de rayos X, difracción de electrones, espectroscopia molecular). Analizando la información estructural de muchos compuestos se han construido distintos modelos. Uno de los más sencillos es el modelo de las “repulsiones de los pares de electrones de la capa de valencia” o modelo RPECV ( en inglés VSEPR “Valence Shell Electronic Pair Repulsion”), que permite predecir la geometría si se conoce el número de electrones que rodean el átomo central. Según este modelo los pares de electrones (participen en el enlace o no) se disponen alrededor del átomo central de forma que experimenten la mínima repulsión entre sí, es decir adoptando la distribución más alejada en el espacio.
|
Pares de e- |
Geometría básica sin pares solitarios |
1 par solitario |
2 pares solitarios |
3 pares solitarios |
|
2 |
α=180° |
|||
|
3 |
(BCl3) α =120° |
α <120° |
||
|
4 |
(CH4) α =109,5° |
(NH3) α <109,5° |
(H2O) α <<109,5° |
|
|
5 |
(PCl5) α =120°, β =90° |
(SF4) α <120°, β <90° |
(ClF3) β <90° |
(XeF2) β =180° |
|
6 |
(SF6) α =90° |
(BrF5) α <90° |
(XeF4) α =90° |
|
En la figura anterior se representan los tipos de geometría que corresponden a compuestos en los que el átomo central tiene hasta seis pares de electrones. Para cada uno de estos ordenamientos electrónicos puede existir más de una geometría molecular en función del número de pares que se usan para formar enlaces y los que permanecen en el átomo central sin compartirse. Para cada una de estas distribuciones se ejemplifican los casos que corresponden a las distintas geometrías moleculares posibles.
Pese a ser un modelo sencillo, a diferencia del complejo modelo mecanocuántico, tiene una gran utilidad a la hora de predecir la geometría molecular.
Para aplicar el modelo de las repulsiones de electrones de la capa de valencia, lo primero que debe hacerse es representar la molécula que se estudia mediante una estructura de Lewis. El número de pares que aparezcan en el átomo central (número estérico) nos indicará la fila de la tabla anterior que tenemos que elegir, los pares no enlazantes nos dirán la columna y por tanto la estructura definitiva.
En los siguientes enlaces podemos ver buenas presentaciones sobre el modelo:
Molecule Shapes
Comparación de formas.
http://www.mhhe.com/physsci/chemistry/animations/chang_7e_esp/bom3s2_7.swf
Visualización con JMOL
http://www.liceoagb.es/quimiorg/covalente1.html
Base de datos con la geometría de cientos de moléculas.
http://www.stolaf.edu/depts/chemistry/mo/struc/explore.htm
3.3 Hibridación de orbitales atómicos
El modelo RPECV, aunque da correctamente la geometría de las moléculas, no explica determinados aspectos, como, entre otros la equivalencia de los cuatro enlaces en la molécula de metano. Según la teoría del enlace valencia, a partir de las configuraciones electrónicas del hidrógeno y el carbono deberían formarse cuatro enlaces σ, pero uno de estos provendría del solapamiento de dos orbitales s (uno del C y otro del H) y los otros tres del solapamiento de un orbital s (del H) y un orbital p (del C), que como hemos visto antes tendrían formas diferentes.
Sin embargo, las medidas experimentales indican que los cuatro enlaces son equivalentes, tienen la misma longitud y ángulos de 109,5° entre ellos. Esta paradoja puede explicarse profundizando en el estudio de la teoría del enlace de valencia, introduciendo el concepto de orbital hibrido que proporciona una alternativa al modelo RPECV para la descripción de la geometría molecular.
3.3.1 Enlaces sencillos.
Veamos como se explican las configuraciones de algunas moléculas sencillas:
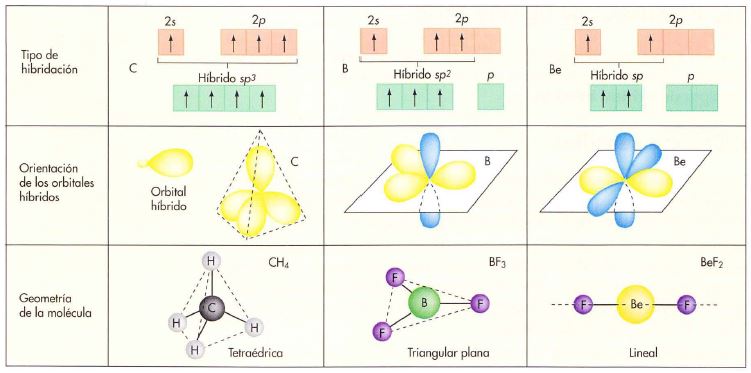
Hidruro de berilio BeH2. El berilio debe tener dos electrones desapareados (1s2 2s1 2p1) para formar dos enlaces covalentes. Para que ambos enlaces sean equivalentes se deben formar dos orbitales híbridos sp combinando el orbital 2s y el orbital 2p del berilio. Los orbitales s del hidrógeno forman enlaces σ con cada uno de estos orbitales.
Hidruro de boro BH3. El boro debe tener tres electrones desapareados ((1s2 2s1 2p1 2p1) para formar tres enlaces covalentes. Para que estos enlaces sean equivalentes se deben formar tres orbitales híbridos sp2 combinando el orbital 2s y los dos orbitales 2p del berilio. Los orbitales s del hidrógeno forman enlaces σ con cada uno de estos orbitales.
Metano CH4. Se supone que se forman cuatro orbitales híbridos sp3 combinando el orbital s y los tres orbitales p del carbono. Los orbitales s del hidrógeno forman enlaces σ con cada uno de estos orbitales.
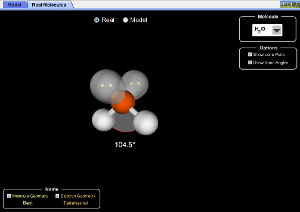
En la hibridación sp3 cada uno de los cuatro orbitales híbridos se dispone hacia los vértices de un tetraedro. Esta es la geometría de la molécula CH4, otras moléculas como el NH3 y el H2O también pueden ser descritas utilizando orbitales híbridos sp3, en el amoníaco uno de los orbitales sp3 del nitrógeno está ocupado por un par de electrones no enlazantes, en el agua dos de los orbitales sp3 del oxígeno están ocupados por dos pares de electrones no enlazantes.
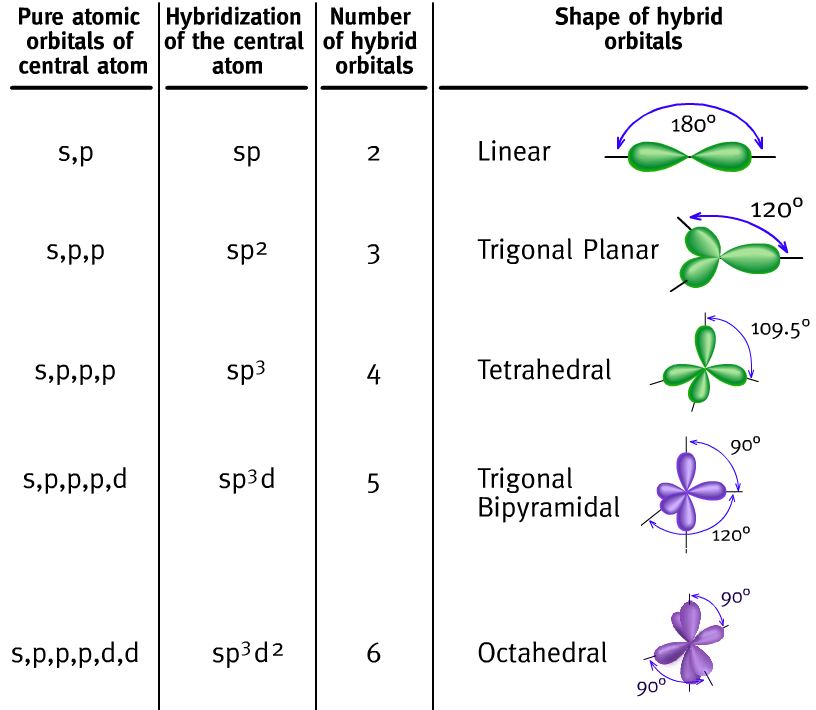
Si el átomo central tiene más de cuatro pares de electrones en su capa de valencia necesitará usar los orbitales “d”, entonces se formarán orbitales híbridos que combinarán orbitales “s”, “p” y “d”, como los de la siguiente animación.
Forma de los orbitales híbridos
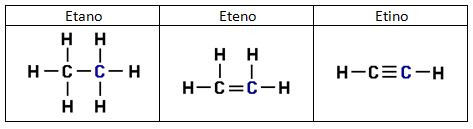
3.3.2. Enlaces múltiples.
a) La molécula de eteno H2C=CH2 tiene geometría plana lo que indica una hibridación sp2, esa es la hibridación que adopta siempre el C en los dobles enlaces. Los dos C del eteno adoptan esta hibridación y se unen entre sí mediante un enlace σ entre dos orbitales sp2 y un enlace π entre los orbitales “p” que no se han hibridado. El resto de orbitales sp2, dos por cada carbono, forma enlaces σ con los orbitales “s” de los átomos de hidrógeno.
b) La molécula de etino HC≡CH adopta una geometría lineal lo que indica una hibridación sp, esa es la hibridación que adopta siempre el C en los triples enlaces. Los dos C del eteno adoptan esta hibridación y se unen entre sí mediante un enlace σ entre dos orbitales sp y dos enlaces π entre los orbitales “p” que no se han hibridado. El resto de orbitales sp, uno por cada carbono, forma enlaces σ con los orbitales “s” de los átomos de hidrógeno.
Presentación FLASH
http://www.mhhe.com/physsci/chemistry/animations/chang_7e_esp/bom5s2_6.swf
3.4. Polaridad de enlaces y de moléculas
3.4.1. Polaridad de enlaces
En el enlace covalente entre átomos iguales el par de electrones del enlace covalente se sitúa entre los núcleos de los átomos implicados y equidistante de ambos. En los demás casos tiende a ocupar una posición más cercana al núcleo del átomo más electronegativo, la densidad de la nube de electrones será mayor cerca de ese átomo. Se crea entonces un dipolo eléctrico, ya que las cargas negativas están desplazadas hacia un lado del enlace.
Así, la molécula de HCl será polar ya que el átomo de cloro es más electronegativo que el de H y por lo tanto atrae con más fuerza los electrones. Esto podemos representarlo como:
Esto indica que el átomo de cloro adquiere una carga parcial negativa (δ-) y el átomo de hidrógeno adquiere una carga parcial positiva (δ+). Los símbolos δ+ y δ- indican que no se llega a alcanzar la carga de un electrón, sino una fracción de ella, es decir, no llegan a formarse iones.
Existiría pues, una gradación entre un enlace covalente no polar (apolar) y un enlace iónico. El enlace iónico sería un caso límite de enlace covalente de máxima polaridad. Por otra parte podemos considerar el enlace covalente polar como de parcialmente iónico. Cuanto mayor sea la diferencia de electronegatividad entre los elementos que forman el enlace, mayor será la polaridad y mayor el carácter iónico del mismo. Así los siguientes enlaces irían aumentando su polaridad, desde el flúor molecular, covalente apolar, hasta el fluoruro de litio totalmente iónico. F-F, O-F, N-F, C-F, B-F, Be-F, Li-F
|
Enlace apolar |
Enlace polar, con μ |
|
|
La polaridad del enlace se caracteriza por el momento dipolar, vector dirigido (por convenio) de la carga positiva hacia la negativa cuyo valor viene dado por la expresión μ = δ+ · d0 , donde μ es el momento dipolar, δ+ la densidad de carga y d0 es la longitud del enlace
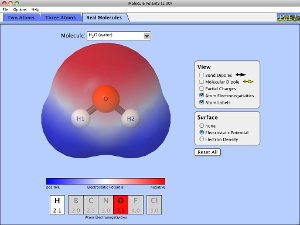
3.4.2. Polaridad de moléculas
Solo para moléculas diatómicas coincide su polaridad coincide con la del enlace. Puesto que las demás moléculas deben tener varios enlaces, el momento dipolar de la molécula no coincidirá con la de un enlace.
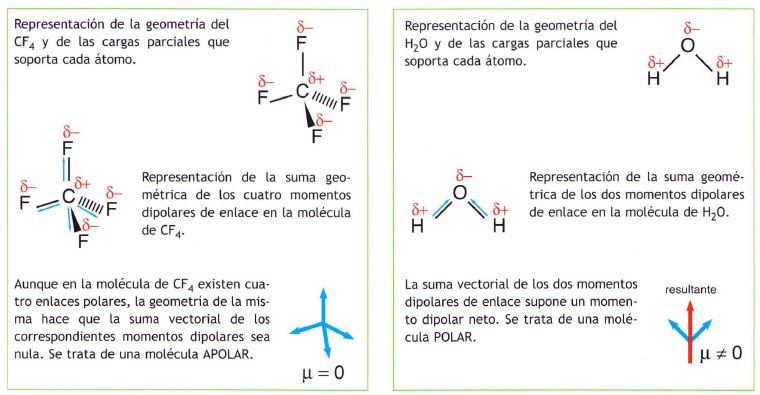
El momento dipolar de la molécula sale de la suma vectorial de los momentos dipolares de cada enlace, orientados según indica la geometría de la molécula.
Si se dan las condiciones adecuadas de simetría, una molécula puede ser apolar incluso teniendo enlaces polares. Esto ocurre en las siguientes: BeF2, BF3, CH4
Conviene pues distinguir entre polaridad de un enlace y polaridad de una molécula.
3.5. Longitud y energía de enlace
3.5.1. Longitud de enlace
En las moléculas, los átomos que forman un enlace dado están siempre vibrando uno con respecto al otro, de modo que no hay una distancia fija y única entre cualquier par de átomos.
Longitud de enlace es la distancia promedio existente entre los núcleos de los átomos enlazados. Representa la distancia de equilibrio entre los núcleos atómicos correspondiente al valor de la energía de enlace en la curva de acercamiento interatómico. (Ver figura de la introducción)
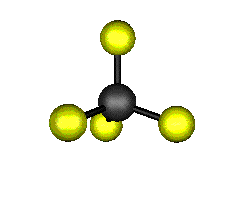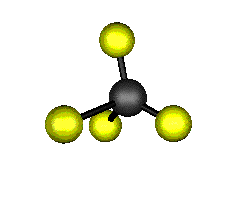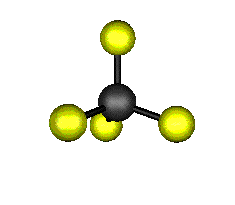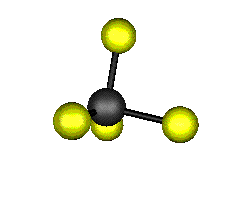
Aquí podemos ver los modos normales de vibración del tetracloruro de carbono:
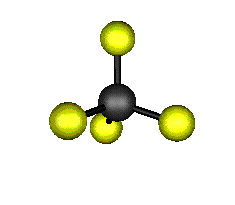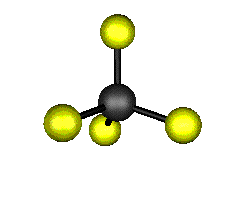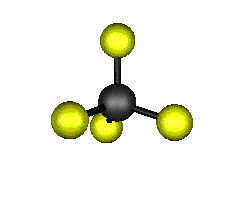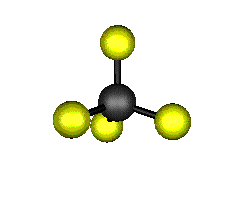 |
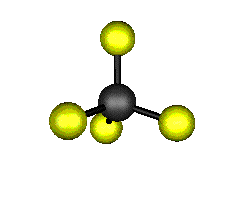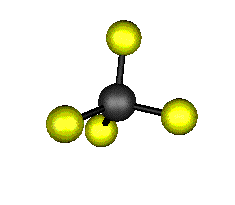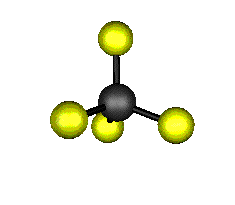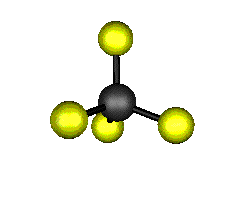 |
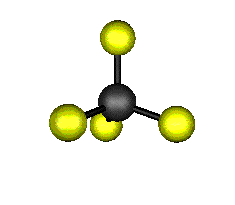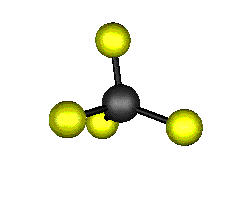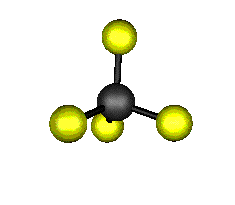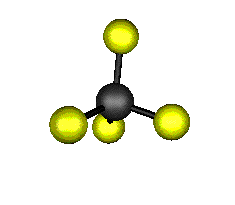 |
 |
MODOS NORMALES DE OTRAS MOLÉCULAS
Entre un mismo par de átomos en diversos compuestos existe una gran diferencia entre sus respectivas longitudes de enlace, según el número de enlaces covalentes (orden de enlace) implicados en la unión. Por ejemplo la distancia de enlace C-C en el etano es 1,54 Å, C=C en el eteno es 1,34 Å y C≡C en el etino es 1,20 Å
3.5.2. Energía de enlace
La energía de enlace es la que se desprende cuando se forma un enlace entre dos átomos en estado gaseoso y fundamental. Se obtiene experimentalmente a partir de la energía de disociación.
Cuanto mayor sea la energía de enlace, más fuerte y estable será el enlace. La energía de enlace depende fundamentalmente de la longitud de enlace y de la polaridad del enlace covalente.
3.6. Fuerzas intermoleculares.
Los átomos, al unirse mediante enlaces covalentes forman moléculas. Si no hubiese fuerzas que las enlazasen todas las sustancias covalentes moleculares serían gaseosas a cualquier temperatura, pero sabemos que esto no es así, por lo tanto deben existir fuerzas intermoleculares. Veamos algunas.
a) Fuerzas de Van der Waals
Hay varios tipos de fuerzas de Van der Waals.
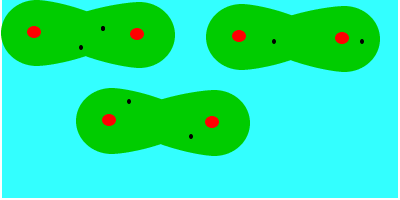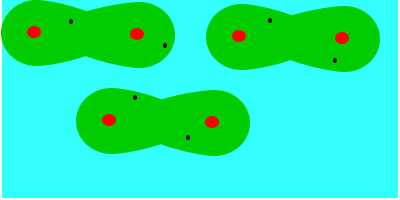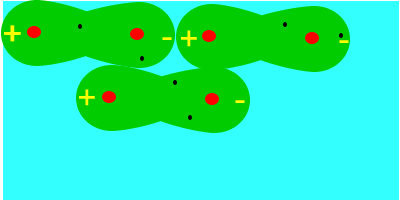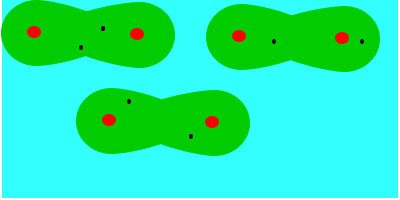
En primer lugar, fuerzas de orientación (entre un ión y un dipolo permanente o entre dos dipolos permanentes), las que se verifican entre moléculas polares, donde el extremo positivo de una se acerca al extremo negativo de otra, y así sucesivamente.

En segundo lugar, fuerzas de inducción (entre un dipolo permanente o un ión y un dipolo inducido), una molécula polar induce un dipolo en una molécula apolar próxima.


En tercer lugar fuerzas de dispersión o fuerzas de London (entre dipolos inducidos), que se deben al movimiento de los electrones, que aleatoriamente adoptan una distribución asimétrica que hacen de la molécula apolar un pequeño dipolo instantáneo. Este dipolo puede inducir otro en una molécula vecina, que a su vez influye en otra y así sucesivamente. Como resultado de ello se produce, en todo momento, una atracción entre las moléculas. Las fuerzas de Van der Waals son debidas, en este caso, a la formación de dipolos instantáneos.


Las fuerzas de Van der Waals son, en la mayoría de los casos, fuerzas muy débiles. Estas fuerzas aumentan con el tamaño de las envolturas electrónicas, por lo que, aproximadamente, puede decirse que aumentan con la masa molecular, ya que en esas condiciones la molécula se hace más polarizable. Esta dependencia del tamaño se puede apreciar en las temperaturas de ebullición en ºC de los hidrocarburos lineales:
|
Metano |
Etano |
Propano |
Butano |
Pentano |
Hexano |
Decano |
|
-164 |
-88,6 |
-42,1 |
-0,5 |
36,1 |
68,7 |
164 |
b) Enlace de hidrógeno.
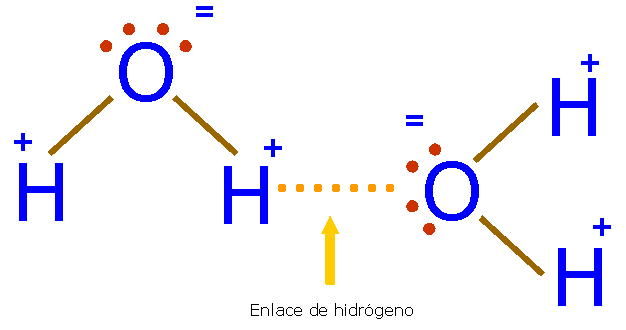
Los puntos de fusión y ebullición de los hidruros de la familia del oxígeno aumentan progresivamente con el tamaño molecular. Según esto, el punto de ebullición del agua debería ser del orden de -80ºC, pero sus puntos de fusión y de ebullición son mucho más altos. Esto sugiere que entre sus moléculas hay fuerzas más intensas que entre las del resto de los hidruros. Estas fuerzas se deben al enlace de hidrógeno o enlace por puente de hidrógeno que se representa mediante una línea de puntos.
En el agua, el par de electrones de cada enlace H-O está muy desplazado hacia el O, muy electronegativo. El protón (núcleo del H) queda casi sin carga negativa, formando un polo positivo que se va a unir electrostáticamente con un par de electrones no enlazante (orbitales “p”) del átomo de oxígeno de una molécula cercana. Por tanto tenemos una unión entre dipolos permanentes muy intensa.
Sólo se dan enlaces de hidrógeno con el flúor, el oxígeno y el nitrógeno que tienen gran diferencia de electronegatividad con el hidrógeno y son átomos pequeños con lo que pueden acercarse mucho al átomo de hidrógeno aumentando así el momento dipolar y la fuerza del enlace.
También existen enlaces de este tipo en compuestos orgánicos tales como alcoholes, fenoles, ácidos, aminas y amidas. El enlace de hidrógeno con O y con N tiene gran importancia, ya que es el responsable de la estructura en hélice de las proteínas y de la unión de las dos cadenas del ADN formando la doble hélice característica.
3.7. Propiedades de las sustancias covalentes
Entre las sustancias con enlaces covalentes podemos distinguir dos tipos, con estructura y propiedades muy diferentes.
a) Sustancias moleculares
Pertenecen a este grupo las sustancias constituidas por moléculas cuyos átomos están unidos por enlace covalente. Entre ellas hay sustancias que a temperatura ambiente suelen estar en forma gaseosa, sobre todo aquellas en las que el enlace es apolar (He, H2, O2, N2, CH4, NH3, HCl, SO2, NO2, etc...), en forma líquida (H2O, Br2, CH3-CH2OH, ClCH2-CH3, etc…) e incluso en estado sólido (I2, naftaleno, glucosa, etc…).
Propiedades físicas de las sustancias moleculares:
- Las temperaturas de fusión y de ebullición son bajas. En condiciones ordinarias, la mayoría de estas sustancias se encuentran en estado gaseoso como hemos indicado antes, otras son líquidas y las menos se encuentran en estado sólido. Estas últimas subliman con facilidad ya que la presión de vapor cerca del punto de fusión es muy elevada y en general funden por debajo de los 300 ºC. Esto se deriva de la debilidad de las fuerzas intermoleculares, una pequeña agitación térmica es suficiente para desordenar y separar las moléculas. Así se explican las bajas temperaturas de fusión y de ebullición.
- Suelen ser blandos, compresibles y fácilmente deformables. Esto se debe a que las fuerzas de Van der Waals no son direccionales.
- Las sustancias apolares son insolubles en disolventes polares como el agua, pero se disuelven bien en disolventes apolares como el tetracloruro de carbono. Las sustancias polares son más solubles en agua. Esto se debe a que la disolución sólo es posible si las fuerzas de atracción que ejercen las moléculas del soluto entre sí, y las moléculas del disolvente entre sí, pueden intercambiarse, lo que ocurre si son de la misma naturaleza y parecida intensidad.
- Las sustancias que forman cristales moleculares son, en general, buenos aislantes eléctricos. Esto se debe a que las moléculas no poseen carga eléctrica neta y, por tanto, no pueden transportar la carga como la transportan compuestos iónicos fundidos. Además, los electrones que forman los enlaces covalentes están fijos en sus orbitales moleculares lo que impide su desplazamiento, ello impide una conductividad similar a la de los metales.
b) Sustancias con red covalente (o reticulares)
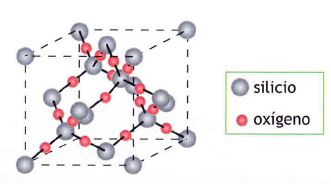
Por qué el CO2 es gaseoso en condiciones normales y el SiO2 es un sólido de gran dureza si son dióxidos de elementos contiguos de la misma familia. La razón es la diferente estructura de uno y otro. El dióxido de carbono está formado por moléculas discretas de CO2 y SiO2 forma una red cristalina covalente.
Cada átomo de silicio se dispone de forma tetraédrica rodeado de cuatro O. No hay moléculas individuales, un cristal de sílice es como una gigantesca molécula, ya que todos los átomos que lo constituyen están unidos entre sí por enlaces covalentes. El CO2 no puede tener estructura análoga pues el pequeño volumen del átomo de C le impide rodearse de cuatro átomos de 0, que estarían demasiado próximos entre sí y sufrirían la repulsión de sus nubes electrónicas.
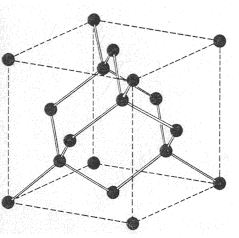
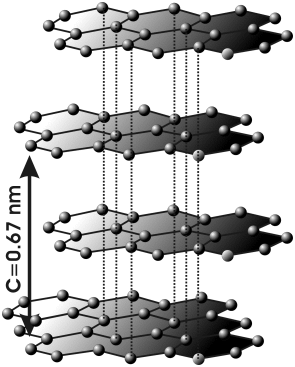
El carbono, en la variedad alotrópica diamante, muestra una estructura cristalina covalente, tetraédrica (hibridación sp3), muy parecida a la del Si02. Pero, en la variedad de grafito, el mismo carbono, muestra una estructura covalente en capas de hexágonos (hibridación sp2).
Suelen presentar estructuras con red covalente los elementos situados en la diagonal: B, C, Si, Ge, As, Sb, etc., de la tabla periódica.
Propiedades de las sustancias reticulares.
Tienen temperaturas de fusión muy elevadas (hasta 4000ºC en el diamante) ya que la fusión de un cristal atómico requiere la ruptura de un gran número de enlaces covalentes, muy fuertes.
Son muy duros e incompresibles, ya que los enlaces covalentes tienen direcciones fijas en función de la hibridación que se forme y cualquier deformación en sólidos como Si02, Si o C (diamante) implica la ruptura de múltiples enlaces covalentes, lo que requiere una gran cantidad de energía.
Son insolubles ya que su disolución requiere también la ruptura de gran cantidad de enlaces covalentes.
En general no conducen la electricidad, aunque hay algunas excepciones (el grafito puede conducir en las direcciones paralelas a los planos hexagonales)
4. Enlace metálico
4.1. Propiedades de los metales.
Las siguientes propiedades son comunes a todos los metales:
• En las estructuras cristalinas metálicas, el número de átomos por los que se ve rodeado un átomo particular es elevado. Este número se denomina número de coordinación.
• Buenos conductores de la electricidad, tanto en estado sólido como fundidos. Un aumento de temperatura disminuye su conductividad eléctrica.
• Alta conductividad térmica.
• Densidades generalmente elevadas.
• Son dúctiles (se pueden alargar en hilos) y maleables (capaces de ser reducidos a láminas).
• Emiten electrones si se calientan (efecto termoiónico) o por la acción de luz de una determinada frecuencia (efecto fotoeléctrico).
• Temperaturas de fusión y de ebullición relativamente elevadas. Todos los metales, salvo el mercurio, tienen temperaturas de fusión superiores a los 25ºC.
• Poseen brillo metálico.
• Son insolubles en agua y en disolventes orgánicos. Algunos metales reaccionan con el agua.
Se debe señalar que entre los propios metales existen grandes diferencias en cuanto a los valores de una determinada propiedad. Existen valores muy distintos cuando se comparan metales representativos con metales de transición.
Densidad en g/cm3 del Li (0,53), del Os (22,48)
Temperatura de fusión en ºC del Hg (-38,9), del W (3380)
4.2. Modelo de enlace metálico
Las propiedades anteriores -especialmente los altos índices de coordinación de los metales, la existencia de pocos electrones de valencia y sus bajos valores de energía de ionización- son difíciles de explicar mediante la formación de enlaces covalentes o iónicos y permiten establecer un modelo de enlace metálico, diferente a los dos anteriores.
Existen diversas teorías que tratan de dar explicación a la forma en que están unidos los átomos en los metales (y sus aleaciones) ya las propiedades más características de los mismos.
4.2.1. Modelo del gas electrónico o del mar de electrones
Este modelo se basa en la suposición de que los metales están formados por la aglomeración de iones positivos bañados por un mar de electrones o sumergidos en un gas electrónico.
En esta situación, los electrones no pertenecen a los átomos individuales, sino que todos ellos son comunes al conjunto de los átomos que forman la red; es decir, están deslocalizados.
Esto explicaría su relativa facilidad para desplazarse por la estructura metálica, lo que produce las elevadas conductividades halladas y los efectos de emisión electrónica.
Esta teoría también justifica las especiales características de moldeo que tienen los metales pues, al aplicar una fuerza, se produce un desplazamiento de las capas iónicas en las estructuras que no produce una variación importante en las mismas, por lo que no se rompen. En cambio, en el caso de cristales iónicos se observa una gran inestabilidad de tipo electrostático por estos desplazamientos.
4.2.2 Modelo de bandas
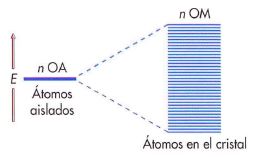
Actualmente, las teorías del enlace metálico parten del hecho de que los metales están formados por átomos que tienen relativamente pocos electrones de valencia, los cuales tienen libertad de movimiento por toda la estructura del metal. El solapamiento de los orbitales de valencia forma una gran banda de conducción.
Presentaremos este modelo empleando como ejemplo el enlace metálico de un elemento alcalino como el litio. En este modelo consideraremos la formación de iones litio (Li+) y de electrones libres que pueden ocupar la banda de conducción por aplicación de un campo eléctrico. La estabilidad de la red metálica se debe a la atracción electrostática que se produce entre la nube de carga negativa de los electrones y los iones positivos que ocupan posiciones fijas.
El orbital 2s de un átomo de litio, con un único electrón, puede solaparse con los orbitales 2s de todos los átomos de litio que le rodean para producir un conjunto de orbitales deslocalizados que se extienden de forma continua por todos los átomos de la red cristalina.
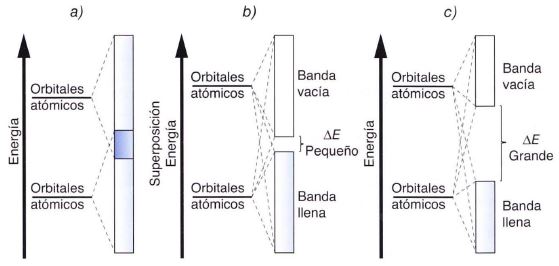
Conductores, semiconductores y aislantes.
Los metales, con 1 e- en el orbital s, como el litio, tendrán una banda formada por la combinación de todos los orbitales s de los átomos metálicos, esta banda estará semillena, pues contendrá la mitad de electrones que caben en ella; será la banda de valencia. Los electrones se situarían en la parte baja de la banda, que es donde hay menor energía. La aportación de una mínima cantidad de energía a dicha banda provocaría una fácil y rápida movilidad de sus electrones, lo que explicaría su gran conductividad. Lo mismo ocurrirá con el resto de los metales que tienen orbitales d sin rellenar completamente, la movilidad de los electrones por banda d formada será grande y, por tanto, la conductividad también.
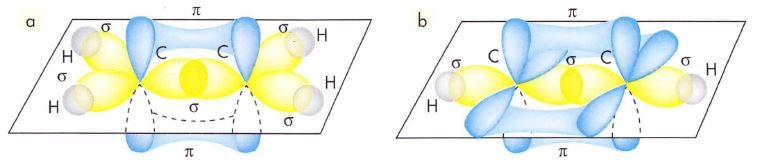
En el caso de metales con el orbital s lleno, la banda de valencia también lo estará, pero la banda superior formada por los orbitales p vacíos, llamada banda de conducción, aparece con energía similar, por lo que se solapa con aquella creándose un gran espacio de libre movilidad electrónica a poca energía que se les comunique. (Apartado “a” de la figura)
La teoría de las bandas de conducción no sólo explica la conductividad eléctrica de los metales, .sino que también puede interpretar el carácter semiconductor de algunos elementos como el germanio. Algunas sustancias, que en principio se comportan como aislantes, pueden conducir por irradiación o por calentamiento. Ello es así porque por encima de la banda de valencia (que está llena) existe otra banda de niveles de energía permitidos, siendo relativamente pequeña la diferencia de energía entre ambas bandas. Si se aporta suficiente energía, los electrones pueden saltar de una banda a otra, facilitando de esta forma la conducción eléctrica. (Apartado “b” de la figura)
Si es muy diferente la energía correspondiente la banda de valencia con respecto a la banda de conducción, la sustancia se comportará siempre como un aislante. (Apartado “c” de la figura)
Explicación de las propiedades de los metales mediante el modelo de enlace metálico
- Conductividad eléctrica
Cuando un campo eléctrico se aplica a un metal, los electrones, que tienen facilidad de movimiento, experimentan una fuerza que los hace desplazarse en la dirección del polo negativo al positivo. Un aumento de temperatura aumenta la velocidad de los electrones y la frecuencia y amplitud a la que vibran los 'restos atómicos' (cationes metálicos). El número de choques entre los electrones y los iones aumenta, dificultando con ello la conductividad eléctrica.
Si profundizamos un poco más, podemos explicar la conducción eléctrica mediante la absorción de energía por parte de los electrones por acción de un campo exterior. Los electrones excitados pasan a poseer contenidos energéticos correspodientes a niveles próximos permitidos de la banda de conducción.
- Conductividad térmica
Debido a su libertad de movimiento, los electrones son capaces de aumentar su energía cinética en las zonas calientes del metal y transferirla mediante choques a otras de menor temperatura.
- Ductilidad y maleabilidad
Ya que la distribución de cargas es más o menos uniforme, los iones positivos pueden desplazarse unos con respecto a otros con relativa facilidad , siempre y cuando los desplazamientos se realicen sin modificar las distancias internucleares medias. El desplazamiento de los iones positivos no produce grandes fuerzas repulsivas ya que la 'nube de electrones' proporciona una amortiguación de la interacción entre iones positivos.
- Brillo metálico
La incidencia de luz sobre la superficie del metal provoca que los electrones 'libres' del metal vibren a una frecuencia idéntica a la de la luz incidente. Esta vibración de una carga eléctrica provoca la emisión de ondas electromagnéticas de la misma frecuencia que la luz incidente. En consecuencia, la luz se refleja en la superficie del metal, lo cual le otorga el brillo característico.
- Temperaturas de fusión, dureza y entalpías de sublimación
Las elevadas temperaturas de fusión y dureza de la mayoría de los metales indican que el enlace metálica es bastante fuerte. Las temperaturas de fusión y la dureza se incrementan con el aumento en el número de electrones de valencia del metal, ya que ello comporta unas fuerzas de atracción mayores entre los cationes metálicos y los electrones. Una medida de la estabilidad relativa de los sólidos metálicos podría ser la comparación de los valores de sus temperaturas de fusión y de ebullición. Sin embargo, estas variaciones no son graduales ya que la fusión de los sólidos no siempre comporta la ruptura del mismo número de enlaces, ni produce fundidos de la misma constitución. Una magnitud que varía de un modo más regular es la entalpía de sublimación. Este valor es una medida de la energía necesaria para romper todos los enlaces presentes.
Los metales de transición presentan algunas diferencias con respecto a los elementos metálicos de los elementos representativos en cuanto a sus propiedades físicas y enlaces. En general sus temperaturas de fusión suelen ser muy elevadas. Estas propiedades se deben, en parte, al reducido tamaño de los átomos y, principalmente, a la existencia de algunos enlaces covalentes producidos por apareamiento de algunos electrones d.